La diarrea neonatal del ternero es una de las causas más importantes de pérdidas económicas para el ganado bovino alrededor del mundo, retrasa su crecimiento, aumenta los costos de cuidado y lleva potencialmente a la muerte de los animales afectados. (Mee J, 2008, Torsein et al., 2011, Azizzadeh et al., 2012, Maganck et al., 2014). Se estima que el riesgo del padecimiento ronda el 20% y que su mortalidad puede llegar sobrepasar el 50% de la mortalidad de animales menores a 30 días (USDA, 2018).
Se trata de una enfermedad compleja a la que le asocia a factores infecciosos y no infecciosos (Bartels CJ, et al., 2010, Izzo et al., 2011). Entre las etiologías infecciosas primarias tenemos a las cepas enteropatógenas de E. coli y Salmonella spp., rotavirus bovinos del grupo A (GARV), coronavirus bovinos (BCoV) y protozoarios como Cryptosporidium spp.y Eimeria spp. (Thomson et al., 2017, Dall Agnol et al., 2021).
Para tratar y prevenir esta enfermedad muchas veces se utilizan antibióticos sistémicos sin que estos sean realmente necesarios, lo que acelera la aparición y propagación de cepas resistentes a antibióticos, cuadros de disbiosis y el retraso en el desarrollo de la diversidad y estabilidad del microbioma intestinal del ternero (Villot et al., 2020).
En serie de entradas revisaremos qué hacer ante un caso y cómo manejar la investigación de un brote de una manera practica sin dejar de lado los fundamentos teóricos que la sustentan, acompáñenos.
Etiología y fisiopatología
Para ahondar en las acciones específicas primero hay que entender el problema que se está afrontando, no todas las diarreas son iguales y conocer la forma en que afectan a los animales puede ayudar a mejorar las propuestas terapéuticas durante situaciones criticas y lograr una tasa de éxito superior.
E. coli enteropatógena (ETEC)
Es la principal causa de diarrea en terneros de menos de 5 días y rara vez es el agente primario en terneros de mayor edad. Las E. Coli son bacterias extremadamente comunes por lo que los cultivos fecales sólo son útiles si se realizan con el fin de demostrar la presencia de los factores de virulencia asociados a las fimbrias (como los F5, F41 o 987P) y la producción de toxinas termoestables (STa y STb).
La expresión del F5 requiere de un pH mayor a 6.5 por lo que la región distal del intestino delgado (íleon) es el sitio de colonización inicial para esta bacteria aunque su habilidad para unirse al epitelio intestinal es edad dependiente y gradualmente disminuye desde las 12 horas de nacidos (van Verseveld et al., 1985, Francis et al., 1989).
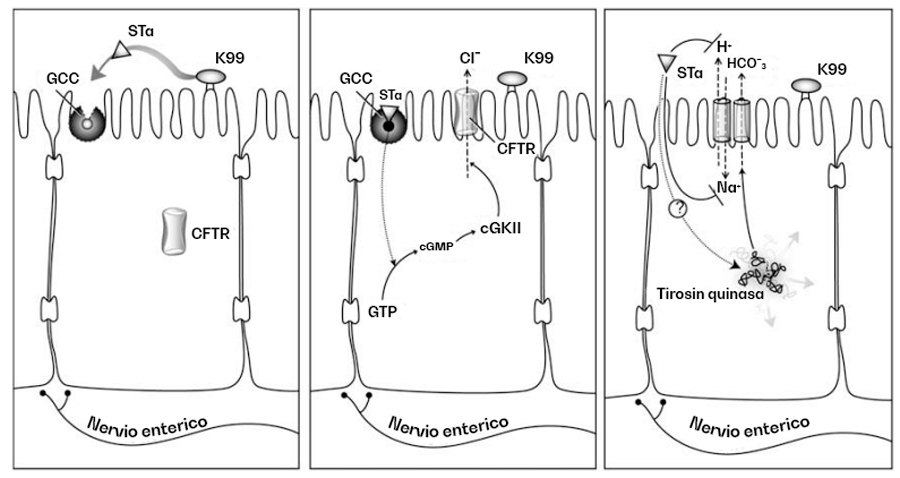
Una vez establecida en el intestino, la ETEC produce una toxina termoestable (Sta) que es la responsable de la diarrea secretoria. La STa se une al guanilil ciclasa-C (GCC), una enzima que se encuentra en las microvellosidades del enterocito y lleva a la producción intracelular de guanilil monofosfato cíclico (GMPc), que actúa como segundo mensajero para activar la proteína quinasa II dependiente de GMPc (cGKII) (Figura 1).
La cGKII se encarga de fosforilar el regulador de la conductancia transmembrana de la fibrosis quística (CFTR) e induce el movimiento de la proteína hacia la superficie celular, resultando en su activación, la secreción de cloruro y movilización osmótica de agua hacia la luz intestinal. También se sabe que la STa induce la secreción de bicarbonato por un mecanismo aún no completamente descrito.
Recomendaciones especificas para su tratamiento
Basándonos en la fisiopatología de la diarrea por ETEC, tenemos que maximizar la absorción de sodio a través de medios distintos al intercambiador Na+/H+ (NHE-1) (porque la STa puede estar inhibiéndolo).
Podemos usar soluciones rehidratantes que aprovechen los cotransportadores de sodio-glucosa para mantener al ternero hidratado y alejarnos de las soluciones con bicarbonato ya que el aumento de pH en el abomaso favorece la proliferación de ETEC, la expresión del F5 y la secreción de STa.
Cryptosporidium spp.
Se considera una causa importante en los brotes transmitidos por agua y es uno de los patógenos más aislados en terneros, aunque rara vez genera signos clínicos después de los 3 meses de edad (O’Handley RM et al., 1999, Ralston et al., 2003, Santin et al., 2004). La exposición a Cryptosporidium spp. en animales jóvenes genera cuadros diarreicos que se intensifican hasta llegar a un pico a los 3 o 5 días post infección y pueden durar de 4 a 17 días (Argenzio et al., 1990, Fayer et al., 1988).
El ciclo de vida del Criptosporidium spp. inicia al entrar en contacto con el ácido gástrico y sales biliares, estimulo que lleva a la exquistación de los oocitos ingeridos por el ternero para volverse un esporozoíto. Los esporozoítos invaden principalmente el epitelio intestinal del ilion pero pueden infectar cualquier parte del tracto gastrointestinal desde el abomaso hasta el colon.
Luego de formar una vacuola parasitófora, estructura intracelular, extracitoplasmática formada de la invaginación de la membrana luminal los esporozoitos se transforman en trofozoitos, se reproducen asexualmente y liberan merozoitos al lúmen intestinal. Estos merozoitos forman merontes tipo I y tipo II que forman micro y macrogamonte. Los micro y macrogamontes se reproducen sexualmente y forman oocitos de pared delgada (que autoinfectan al hospedero) y de pared gruesa (que son expulsados en las heces) (figura 2).
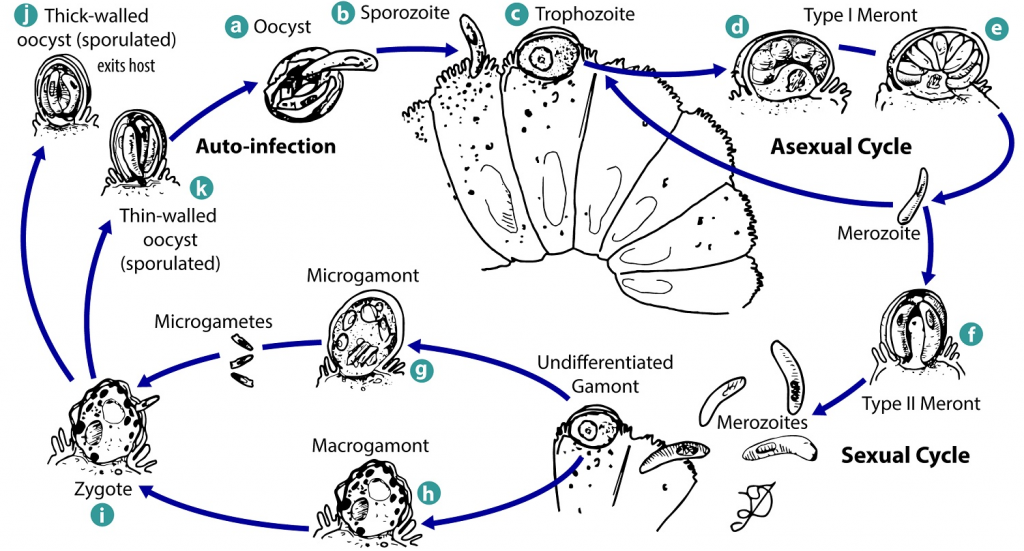
La infección por Cyptosoridium spp. induce la atrofia de las microvellosidades intestinales del ternero y otras especies. Compensatoriamente, para reemplazar la perdida de células epiteliales las criptas inician un proceso de hiperplasia pero en infecciones severas esto no es suficiente para mantener la integridad de la barrera epitelial.
Existen dos posibles mecanismos que mediarían el incremento de la perdida de células epiteliales durante la infección, 1) un efecto citotóxico del mismo organismo, aunque la literatura actual ya no lo respalda y 2) la perdida celular por apoptosis, que es inhibida por los trofozoítos justamente en el momento que son más dependientes de las células que parasitan (para una revisión más extensa de este fenómeno por favor revisar Mele et al., 2004).
Independientemente del mecanismo, la atrofia lleva a una diarrea malabsortiva ya que la tasa de absorción se ve disminuida por la falta de células epiteliales maduras y la reducción del área de superficie en el intestino. La absorción de sodio y agua aún es posible en las criptas siempre y cuando se encuentren asociadas a glucosa o aminoácidos neutros..
La perdida de de epitelio intestinal, la atrofia de las vellosidades y la consecuente mala absorción no representa la totalidad de la fisiopatología en esta enfermedad. Existen estudios que muestran una secreción de aniones CL– y HCO3– mediada por prostaglandinas y la inhibición de la absorción de NaCl. Las prostaglandinas involucradas son las PGE2 y PGI2, que se encuentran en concentraciones más elevadas en los tejidos infectados y al bloquear la secreción de esas prostaglandinas se revierte la secreción e inhibición de la absorción de NaCl(Gookin et al., 2002, Argenzio et al., 1993). Sin embargo la inhibición de prostaglandinas invivo exacerbaron la atrofia de microvellosidades por lo que no se puede recomendar el uso (Zadrozny et al., 2006).
Recomendaciones especificas para su tratamiento
El tratamiento antibiótico más prometedor en el tratamiento de las infecciones por Cyptosoridium spp es la azitromicina aunque la terapia debe enfocarse en la restitución de fluidos y cuando esta sea oral se deberán incluir soluciones que contengan glucosa y/o aminoácidos neutros (como la glicina o metionina) para facilitar su absorción.
Rotavirus
Inicialmente conocido como el “virus de la diarrea neonatal del ternero”, fue una de las primeras causas virales de la diarrea neonatal en bovinos. Afecta predominantemente a terneros de menos de 3 semanas y principalmente a los de 6 días. Los terneros se infectan al ingerir partículas virales de ambientes contaminados (principalmente de heces) , desarrollan la enfermedad después de un periodo de incubación de aproximadamente 24 horas y en casos no complicados se resuelve en 2 días.
Inicialmente se consideraba que la diarrea por rotavirus era por mala absorción pero ahora contamos con cierta evidencia que nos podría indicar que también incluye un componente mediado por toxinas. La glicoproteína no estructural 4 (NSP4) del rotavirus demostró inducir una diarrea dosis y edad dependiente clínicamente similar a la ya descrita. A diferencia de otras enterotoxinas, la NSP4 no se relaciona con el AMPc, GMPc ni CFTR. La proteina es liberada luego de la muerte celular y actúa como señalizador paracrino.
La exposición intracelular y extracelular al NSP4 genera varios cambios en el movimiento de nutrientes y agua a través del epitelio. incrementa las concentraciones de calcio intracelular (componente secretorio), inhibe la translocación de disacáridos desde las vesículas intracelulares hacia la superficie del lumen, disminuye la habilidad de digerir carbohidrato e inhibe los cotransportadores sodio-glucosa tipo 1(SGLT1). Por lo que podríamos considerar que la acción del NSP4 en la maldigestión, malabsorción y secreción es más importante que el daño histológico sobre el epitelio durante esta infección.
Recomendaciones especificas para su tratamiento
No existe tratamiento especifico pero el enfoque de la rehidratación debe ir en prevenir la acidosis metabólica. Para mejorar la resistencia de los terneros se puede iniciar un programa de vacunación a las vacas secas pero debe ir acompañado de un buen manejo del calostro y asegurar una correcta transferencia de la inmunidad pasiva.
Salmonella spp.
De transmisión fecal-oral (aunque también se reportan rutas como la mucosa respiratoria superior y la conjuntiva). La salmonella coloniza el tracto gastrointestinal invadiendo las células C, enterocitos y tejido tonsilar linfoide. En el tejido linfoide la salmonella entra en contacto con los fagocitos mononucleares y son rápidamente diseminados en el cuerpo. La capacidad infectiva de Salmonella vía tonsilas ha sido demostrada en terneros esofagoectomizados.
La salmonelosis aguda se caracteriza por una enteritis catarral con ileotiflocolitis fibrinonecrotica. El contenido intestinal es acuoso y puede contener moco o sangre entera, la inflamación de la vesícula es común y la evidencia histológica de una colecistitis fibrinosa suele considerarse patognomónica para la salmonelosis en terneros. En los casos crónicos, se espera un engrosamiento de las paredes intestinales con un material necrótico gris-amarillento sobre una superficie mucosa roja.
Los mecanismos basicos de virulencia de Salmonella spp incluyen la capacidad de invadir la mucosa intestinal, multiplicarse en tejido linfoide y evadir el sistema inmune del ternero llevandolo a un cuadro de enfermedad sistemica.
Durante mucho tiempo se creia que la diarrea asociada a salmonelosis era inmunomediada. S typhimurium requiere de un sistema de secreción tipo III funcional (presente en las islas de patogenicidad SPI1 y SPI5) para causar diarrea. La principal función de estos sistemas es la translocación de proteinas efectoras en el citosol de las celulas huespedes, resultando en la muerte asociada a la respuesta proinflamatoria e ingreso de neutrofilos a la mucosa intestinal.
La S. Dublin adaptada a los bovinos y algunas cepas de S Typhimurium son portadoras de plasmidos con el gen SpV que promueve su supervivencia en los macrofagos. Esta habilidad para sobrevivir intracelularmente entre celulas reticuloendoteliales de higado y bazo, nodulos linfaticos y macrofagos contribuye a la virulencia.
Una virulencia aumentada es posible en cepas resistentes a antibióticos y los terneros infectados por estas pueden llegar a tener un riesgo 13 veces mayor de morir. Los terneros que mueren de salmonelosis suelen ser bacterémicos por lo que el aislamiento de Salmonella en sangre sirve de evidencia de causalidad y la cepa aislada puede usarse como muestra representativa para las pruebas de antibiogramas.
Recomendaciones especificas para su tratamiento
El tratamiento de la salmonelosis en terneros debe ir dirigido a reemplazar las pérdidas de líquidos y electrolitos, limitando las cascadas inflamatorias mediante el uso de medicamentos antiinflamatorios no esteroideos (AINE) y el uso prudente de antimicrobianos.
Manejo de brotes
Un brote de diarrea neonatal se define como cualquier incremento inesperado en la incidencia o mortalidad de una enfermedad que ocurre en un periodo tiempo y pueden ocurrir mediante un punto de exposición común (epidemia de origen puntual) o ser propagadas (Lessard, 1988).
Antes de implementar alguna medida debemos considerar por qué estamos realizándolas y si cumplen algún objetivo como:
- ¿Reducen las perdidas asociadas a los casos que se presentan?
- ¿Ayudan a prevenir nuevos casos?
Pasos para manejar un brote
El manejo de un brote de diarrea neonatal puede realizarse de varias formas, sin embargo nuestras probabilidades de éxito aumentan significativamente si esquematizamos el proceso:
Entrevistar al personal clave
Obtener información de primera mano de las personas que están en mayor contacto con los animales es de vital importancia. En esta etapa debemos investigar cuales son las practicas que se emplean en la granja y las dificultades que se pudieran estar experimentando para mantener la adherencia a ellas. Como veremos más adelante
Confirmar los diagnósticos clínicos
Para que los animales puedan ser tratados apropiadamente debe existir un diagnóstico. A veces, un brote es realmente la detección de un problema que ha estado en curso durante un tiempo.
Realizar un diagnóstico poblacional
Una vez nos hayamos asegurado que los animales afectados estén recibiendo el tratamiento adecuado, tenemos que determinar las causas de los brotes para frenarlo.
Para el diagnostico poblacional nos interesa clasificar el brote por agente, hospedero y ambiente, es decir:
- El o los patógenos involucrados.
- Los animales susceptibles a la enfermedad
- Los factores que predisponen a la enfermedad
Podemos llegar a un diagnóstico poblacional luego de:
- Establecer o revisar el sistema de registro: Este debe permitir al menos identificar al ternero y proveer datos como su edad, el inicio de la signos e información que describa factores de riesgo de interés.
- Definir los casos: debe tener un nivel de especificidad razonable para evitar no confundir diferentes problemas con uno solo y no explorar solo parte del problema.
- Definir la población en riesgo: Para cada etiología hay subpoblaciones con mayor riesgo, en el caso de la diarrea neonatal (como complejo), un valor apropiado sería terneros de menos 30 días.
- Caracterizar el brote por tiempo, espacio y unidad: Muchas veces la investigación de un brote inicia después que ya ocurrieron. Es posible reconstruirla analizando los registros y graficando la frecuencia de casos con los días de aparición en forma de histogramas.
- Determinar la naturaleza del brote: La forma de la curva epidemiológica nos da una idea de la naturaleza de la enfermedad y los factores que pudieron favorecer la ocurrencia de sus signos clínicos.
- Epidemia de origen puntual: Se caracteriza por una alta prevalencia inicial durante un periodo corto.
- Epidemia propagada: Se observa una curva epidemiológica relativamente plana por un periodo relativamente largo.
- Desarrollar hipótesis sobre los posibles factores causales en base a los datos recolectados previamente, logrando así un diagnóstico presuntivo.
- Probar la hipótesis usando los principios epidemiológicos: Dependiendo de los recursos disponibles, naturaleza del brote y que tan bien se pueda podemos usar diferentes métodos. En la teoría causal de la enfermedad, cada factor que contribuye al desarrollo de la enfermedad es un componente causal y la enfermedad se observa cuando varios componentes se encuentran presentes (Rothman 1976).
Nuestro objetivo en este punto es identificar cuáles son los componentes causales (factores de riesgo) presentes que son suficientes para la aparición de casos. Algunos factores son características del individuo, otros de grupos o rebaños.
- Si un componente clave se encuentra presente a nivel de rebaño, dígase por ejemplo el virus de la DVB, será muy difícil asociarlo comparandoterneros afectados de terneros no afectados en un mismo rebaño.
- La inferencia de que el DVB está contribuyendo a la enfermedad proviene de la comparación con lo que se espera u observa en rebaños negativos al virus.
- Por otro lado, en ese mismo rebaño es posible determinar si la falla en la transferencia de la inmunidad pasiva es también un factor causal si comparamos los niveles de IgG de los terneros afectados y no afectados.
Tipos de investigación de brote
La investigación de un brote puede ser cualitativa o cuantitativa dependiendo de los datos que tengamos a disposición.
Investigación cualitativa
Se utiliza en la mayor parte de investigaciones ya que no se cuentan con los datos apropiados para un análisis cuantitativo. Por lo que dependemos de datos que tienden a ser subjetivos y usaremos usaremos el sistema de lógica inductiva de J. S. Mill para identificar factores causales. Los métodos más usados son:
- El método de concordancia:
“Si dos o más ejemplos de un fenómeno bajo investigación poseen una sola circunstancia en común, esta única circunstancia, presente en todos los ejemplos, es la causa (o el efecto) del fenómeno mencionado.”
Ejemplo: Brotes en diferentes granjas que usan un mismo producto pero que mantienen otras prácticas.
- El método de la diferencia:
“Si una situación en que ocurre el fenómeno en investigación, y otra situación en que no ocurre, se parecen en todo excepto en una circunstancia, que sólo se presenta en la primera situación, entonces esta circunstancia, que es la única diferencia, entre las dos situaciones es el efecto, la causa, o una parte indispensable de la causa, del fenómeno mencionado.”
Ejemplo: Terneros en los que se usó el producto de un lote desarrollaron diarrea y en la misma granja los que usaron los de otra no.
- El método de variaciones concomitantes:
“Cuando un fenómeno varía de alguna manera particular, es causa o efecto de otro fenómeno que varía de la misma o de otra manera, pero concomitantemente.”
Ejemplo: Mientras más tiempo pasen los terneros en el corral de maternidad, mayor es la incidencia de diarrea.
Investigación cuantitativa
Cuando hay datos disponibles, el enfoque cuantitativo es más útil para descubrir las causas y evaluar la efectividad de las intervenciones. Hay 3 diseños básicos para este tipo de estudios:
- Caso control:
Comparan la probabilidad de exposición entre casos y la probabilidad de exposición entre los no casos. Sirven para estudiar la enfermedades raras y cuando hay varias exposiciones potenciales que pueden someterse a prueba.
- Cohorte o longitudinal:
Comparan la incidencia de una enfermedad entre sujetos expuestos contra los que no estuvieron expuestos. Son de utilidad cuando existe la posibilidad de seguimiento (estudio prospectivo) o hay data disponible (estudio retrospectivo).
- Transversales:
Estudian la relación entre la enfermedad y la prevalencia de la exposición en un momento puntual. Son útiles cuando queremos restringir el estudio a un periodo de tiempo corto.
Las medidas de asociación estadísticas son importantes en el diagnostico poblacional ya que nos permiten cuantificar la fuerza de la relación entre los factores de riesgo y la enfermedad. Por ejemplo, cuando un criterio de valoración clínico es dicotómico (ejm: enfermo o no enfermo), la medida de asociación a utilizar será la razón de momios (odds ratio) o el riesgo relativo (RR).
El valor resultante en la razón de momios nos indicara si la exposición al factor tiene un efecto protector (OR < 1), está asociado a la aparición de la enfermedad (OR > 1) o no tiene asociación (OR = 1).
En los estudios cuantitativos es común que también nos valgamos del valor P pero en brotes con un tamaño de muestra pequeño con poco poder para detectar diferencias es difícil llegar al valor consenso de P < 0.05 (que equivale a una tasa de error para rechazar una hipótesis nula verdadera de entre el 25-50% y si quisiéramos una tasa de error cercana al 5% necesitaríamos un P < 0.0027) por lo que algún autor ya habrá recomendado considerar este valor circunstancialmente.
Desarrollar estrategias que prevengan nuevos casos y futuros brotes
Identificando las medidas de control y acciones correctivas basadas en el conocimiento de los factores causales y los determinantes clave. Estas deben ser:
- Fáciles de aplicar: Estar dentro de las capacidades técnicas del personal responsable de ejecutarlas.
- Económicas: Las medidas correctivas no pueden ser más costosas que la enfermedad.
- Efectivas: Debe existir cierta evidencia sobre su utilidad en el control.
- Considerar el impacto de cada factor en:
- Los animales expuestos es decir: ¿Qué proporción de casos son causados por un factor?
- Riesgo atribuible a la exposición = (Riesgo relativo -1) / Riesgo relativo
- La población, revisando la proporción de casos potencialmente prevenidos en la población al corregir el factor a través de el:
- Riesgo atribuible a la población = ProbE x (RR-1) / (ProbE x [RR – 1] + 1)
- Los animales expuestos es decir: ¿Qué proporción de casos son causados por un factor?
Siendo:
RR = Riesgo relativo
ProbE = Probabilidad de exposición
Entre medidas las que podríamos usar (dependiendo de la situación) se encuentran las que:
- Eliminan a los patógenos del rebaño y el ambiente: Bioseguridad y erradicación de animales portadores.
- Mejoran la resistencia del ternero a la enfermedad: Principalmente mejorando la transferencia de inmunidad pasiva, asegurando una ingesta oportuna y apropiada de calostro de buena calidad.
- Modifican el sistema de producción para minimizar la exposición: Cambiando practicas en la granja como separar físicamente a los animales, desinfectando ambientes, segregando a los terneros de mayores a menores, minimizar el tiempo que pasa la madre en el corral de maternidad después de haber parido, etc.
Comunicando las observaciones y el plan de acción al personal clave
Una vez estructurado nuestro plan, las personas involucradas en su ejecución deben ser notificadas e instruidas en las medidas que se vayan a aplicar. No debemos olvidar que estos planes deben incluir un sistema de verificación que permita medir la adherencia a las recomendaciones y monitorizar el progreso que se esté logrando.
En la próxima entrada nos enfocaremos en el manejo de los terneros diarreicos abarcando aspectos que podrán ser claves en su supervivencia: la rehidratación oral y la rehidratación parenteral.
Esperamos que este articulo haya sido de su agrado, no duden en dejarnos sus comentarios, compartirlo en sus redes o suscribirse a nuestro newsletter para no perderse los nuevos artículos que estaremos preparando para Ud. Hasta una nueva oportunidad.
También te puede interesar: Mejorando la transferencia de inmunidad pasiva del ternero
Bibliografía
- Argenzio RA, Liacos JA, Levy ML, et al. Villous atrophy, crypt hyperplasia,
cellular infiltration, and impaired glucose-Na absorption in enteric cryptosporidiosis of pigs. Gastroenterology 1990;98(5 Pt 1):1129–40 - Azizzadeh M, Shooroki H, Kamalabadi A, Stevenson M. Factors affecting calf mortality in Iranian Holstein dairy herds. Preventive Veterinary Medicine. 2012; 104(3–4):335–40. pmid:22230657
- Bartels CJ, Holzhauer M, Jorritsma R, Swart WA, Lam TJ. Prevalence, prediction and risk factors of enteropathogens in normal and non-normal faeces of young Dutch dairy calves. Prev Vet Med. 2010;93:162–169.
- de Graaf DC, Vanopdenbosch E, Ortega-Mora LM, et al. A review of the importance
of cryptosporidiosis in farm animals. Int J Parasitol 1999;29(8)::1269–87. - Fayer R, Gasbarre L, Pasquali P, et al. Cryptosporidium parvum infection in bovine neonates: dynamic clinical, parasitic and immunologic patterns. Int J Parasitol 1998;28(1):49–56.
- Foster, D. M., & Smith, G. W. (2009). Pathophysiology of Diarrhea in Calves. Veterinary Clinics of North America: Food Animal Practice, 25(1), 13–36.
- Harp JA, Woodmansee DB, Moon HW. Resistance of calves to Cryptosporidium
parvum: effects of age and previous exposure. Infect Immun 1990;58(7):2237–40. - Izzo MM, Kirkland PD, Mohler VL, Perkins NR, Gunn AA, House JK. Prevalence of major enteric pathogens in Australian dairy calves with diarrhoea. Aust Vet J. 2011;89:167–173.
- Ma, T., Villot, C., Renaud, D., Skidmore, A., Chevaux, E., Steele, M., & Guan, L. L. (2020). Linking perturbations to temporal changes in diversity, stability, and compositions of neonatal calf gut microbiota: prediction of diarrhea. The ISME journal, 14(9), 2223–2235.
- Mee J. Newborn dairy calf management. Veterinary Clinics of North America: Food Animal Practice. 2008; 24(1):1–17. pmid:18299029
- Meganck V, Hoflack G, Opsomer G. Advances in prevention and therapy of neonatal dairy calf diarrhoea: a systematical review with emphasis on colostrum management and fluid therapy. Acta Veterinaria Scandinavica. 2014; 25(1):1–8. pmid:25431305
- O’Handley RM, Cockwill C, McAllister TA, et al. Duration of naturally acquired giardiosis and cryptosporidiosis in dairy calves and their association with diarrhea. J Am Vet Med Assoc 1999;214(3):391–6.
- Ralston BJ, McAllister TA, Olson MA. Prevalence and infection pattern of naturally acquired giardiasis and cryptosporidiosis in range beef calves and their dams. Vet Parasitol 2003;114(2):113–22.
- Sanderson MW. Designing and running clinical trials on farms. Vet Clin North Am Food Anim Pract 2006;22(1):103–23.
- Santin M, Trout JM, Xiao L, et al. Prevalence and age-related variation of Cryptosporidium species and genotypes in dairy calves. Vet Parasitol 2004; 122(2):103–17
- Torsein M, Lindberg A, Sandgren CH, Waller KP, Törnquist M, Svensson C. Risk factors for calf mortality in large Swedish dairy herds. Preventive Veterinary Medicine. 2011; 99(2–4):136–47. pmid:21257214
- USDA (2018) Health and management practices on U.S. dairy operations, 2014.





