La nutrición es un pilar para el mantenimiento de la salud en todas las especies, tal es así que la deficiencia de uno o más nutrientes altera su capacidad metabólica y la de su sistema inmune, predisponiendolos a una serie de enfermedades.
Por eso, en esta entrada revisaremos las enfermedades de origen nutricional más comunes que se reportan en la crianza de llamas y alpacas y cómo evitarlas.
Table of Contents
Enfermedades asociadas al balance de energía
Desnutrición proteico-energética (DPE)
Se define como una situación de desnutrición donde la energía y/o la proteína son deficientes en la dieta durante un período de tiempo. La perdida de peso y la disminución en la condición corporal son las manifestaciones clínicas más comunes (Carmalt, 2000).
En los animales en crecimiento, se podrá observar una desaceleración o cese casi completo en la ganancia de peso. Las hembras gestantes y lactantes que experimentan DPE tendrán un riesgo más elevado de sufrir tambien de lipidosis hepática (Tornquist et al., 1999).
La causa más común del DPE es la mala calidad forraje junto con la incapacidad del animal para consumir cantidades suficientes para cumplir sus requerimientos (Oetzel, 1988; Carmelt, 2000).
En nuestro medio el crecimiento y calidad del forraje depende de un patrón de precipitación estacional intermitente. Durante el periodo de lluvias, el forraje crece rapidamente y tiene una alta calidad pero por un periodo muy corto (3 a 4 meses). Durante la temporada seca la disponibilidad de forraje es extremadamente limitada, con pastos muy maduros y de baja calidad (Reiner et al., 1987; San Martin and Bryant, 1989; Genin et al., 1994).
Los camelidos ganarán peso, condición corporal y parirán durante la temporada de lluvias, mientras que en la temporada seca perderán peso, condición corporal y experimentarán diferentes estadios de malnutrición (Lopez et al., 1998).
Lipidosis hepática
Todos los animales son susceptibles a la deficiencia y exceso de ingesta de energía relativa a sus requerimientos, sin embargo, los camélidos tienen una predisposición a la lipidosis hepática, condición asociada, aunque no siempre, al balance energético negativo.
El balance energetico negativo induce la mobilización de las reservas de grasas, lo que incrementa los ácidos grasos no esterificados (AGNEs) circulantes a niveles de 0.6 a 1 mEq/L (Cebra et al., 2004). A medida que aumentan los AGNEs que llegan al higado, la producción de beta-hidroxibutirato (BHB) tambien aumenta y llega a concentraciones de 1 a 2 mg/dL.
El aumento de BHB es acompañado de la supreción del apetito, potencialmente mediado por el grado de acidosis, más que el efecto tóxico del compuesto (Cebra et al., 1997). Altas concentraciones de AGNEs pueden ser proinflamatorias o potencialmente citotoxicas por si mismas, además inhiben el almacenamiento hepatico de glucógeno, la absorción de glucosa y pueden incrementar la resistencia a la insulina (Roden, 2004).
Cabe resaltar que las celulas B son inicialmente estimuladas por los AGNEs para liberar insulina pero al estar expuestos de manera crónica, pueden producir una supresión pancreática (Keane et al., 2008).

Recomendaciones
Asegurar una adecuada ingesta de energía y proteina, especialmente en las hembras gestantes y dando de lactar. Esto lo logramos brindandoles un forrage de alta calidad y una suplementación adecuada (Tabla 1).
| Grupo | Periodo | Plan de alimentación | Guía rápida |
| Madres con tui | Lactación | Requerimientos más altos, alimentar los mejores forrajes disponibles, suplementar a necesidad | NDT: 60% – 70% Proteina cruda: 12% – 14% Calcio: 0.45% – 0.62% Fósforo: 0.32% – 0.45% |
| Destetados hasta el año y medio | Crecimiento | Requerimientos más altos, alimentar los mejores forrajes disponibles, suplementar a necesidad | NDT: 55% – 65% Proteina cruda: 14% – 16% Calcio: 0.53% – 0.73% Fosforo: 0.27% – 0.38% |
| Machos > de 1 año | Mantenimiento | Bajos requerimientos, a menos que sean reproductores. Forraje de baja a moderada calidad. | NDT: 55% – 60% Proteina cruda: 8% – 10% Calcio: 0.3% – 0.48% Fosforo: 0.21% – 0.28% |
| Gestantes 1er y 2do tercio | Mantenimiento | Bajos requerimientos, asegurar que no haya perdida de condición corporal y tengan una ingesta adecuada de proteina, vitaminas y minerales | NDT: 50% – 55% Proteina cruda: 8% – 10% Calcio: 0.2% – 0.24% Fosforo: 0.12% – 0.2% |
| Gestantes en ultimo tercio | Preñez (9-11 meses) | Brindar forraje de mediana a alta calidad, suplementar vitaminas y minerales a necesidad | NDT: 55% – 70% Proteina cruda: 10% – 12% Calcio: 0.45% – 0.56% Fosforo: 0.28% – 0.33% |
| Hembras reproductoras | Mantenimiento | Requerimientos bajos a moderados, evitar que engrasen o bajen de condición corporal | NDT: 50% – 55% Proteina cruda: 8% – 10% Calcio: 0.2% – 0.24% Fosforo: 0.12% – 0.2% |
| Hembras obesas | Submantenimiento | Bajos requerimientos, forrajes de baja dencidad nutricional + suplementación con vitaminas/minerales (excepto si están preñadas) | NDT: 40% – 50% Proteina cruda: 8% – 9% Calcio: 0.2% – 0.24% Fosforo: 0.12% – 0.2% |
Enfermedades asociadas a minerales
Deficiencias minerales
Aunque aún no se hayan publicado ensayos que establezcan los requerimientos nutricionales de minerales en camélidos, no existe data que sugiera que estos sean muy distintos a los de los rumiantes.
Deficiencia de cobre
La compleja interacción entre el cobre (Cu), molibdeno (Mo) y azufre (S) suele resultar en la deficiencia de cobre en los camélidos y rumiantes. Esto se debe a que los microorganismos en las cámaras fermentativas de estos animales metabolizan el molibdeno y los sulfatos y los convierten en tiomolibdenatos que luego se unen al cobre y lo vuelven inasimilable.
El cobre forma parte de varias metaloproteinas que requieren de su presencia para ser biológicamente activas. La acción enzimatica de estas hacen que el cobre esté involucrado en la regulación del hierro, el correcto funcionamiento de los globulos rojos, la respiración celular, la pigmentación de las fibras y el sistema inmune.
Un ejemplo de estas proteinas es la ceruloplasmina, una proteina de la sangre que contiene 7 átomos de cobre y se encarga de convertir el hierro almacenado en formas que pueda ser incorporado en la hemoglobina y además juega un papel importante en la inmunidad inespecifica. Además, la mayoría de celulas del sistema inmune están supeditadas al cobre a traves de la actividad del superoxido dismutasa.
Mantener niveles apropiados de cobre tambien es interes para los productores de fibras ya que es vital para mantener la coloración y calidad de estas al ser dependiente de la tirosinasa, otra enzima que contiene cobre y está involucrada en la formación de la melanina. Por otro lado los enlaces disulfuro que le dan las propiedades estructurales a la fibra son también dependientes de cobre.
¿Cómo identificar la deficiencia de cobre?
Las concentraciones de cobre pueden medirse directamente en el plasma, suero e higado, sin embargo sólo los niveles muy bajos (<0.1 μg/ml) o muy altos (>5 μg/ml) tienen valor diagnostico para las muestras obtenidas de la sangre.
Las muestras de biopsias de hígado se consideran las mejores para determinar el estatus nutricional de cobre pero su obtención es invasiva. La recomendación, si es que se tiene acceso a un laboratorio diagnóstico, es usar las concentraciones séricas como prueba de tamizaje en conjunto con los niveles de molibdeno y en caso observemos mortalidades sin explicación, tomar muestras del higado y riñón de los animales afectados para determinar si esta estuvo asociada a la deficiencia de cobre (el punto de corte para determinarlo es <25ppm en base al peso seco).
Tratamiento y control
Se pueden administrar soluciones inyectables de cobre, suplementar más cobre o reducir los inhibidores de cobre en la dieta (reevaluar la necesidad de suplementos altos en zinc). Una vez que los niveles son regularizados la mejora en los animales será evidente en 2 a 4 semanas.
El contenido de cobre dietético recomendado para cumplir con los requisitos diarios de los camélidos varía de 9 a 12 ppm (en base a la materia seca) aunque puede ser mayor en presencia de inhibidores.
La proporción cobre:molibdeno es la recomendable para camélidos sudamericanos es de 4:1 pero como en todos los rumiantes, hay que considerar que el óxido de cobre prácticamente no es absorbible por estos animales (Kegley y Spears, 1994).
Deficiencia de Hierro
La formación de glóbulos rojos requiere de hierro y su deficiencia resulta en una anemia microcítica e hipocrómica, junto con la reducción de la tasa de crecimiento (Morin et al., 1993). En los animales jovenes la ingesta inadecuada de hierro es la causa más común ya que tienen un mayor requerimiento y consumen menos alimento (Morin et al., 1992).
La deficiencia primaria es menos prevalente en animales adultos ya que aún en condiciones de baja disponibilidad de hierro los herbívoros logran cumplir con sus requerimientos. En estos animales la deficiencia de hierro debe principalmente a infestaciones parasitarias (Figura 1).
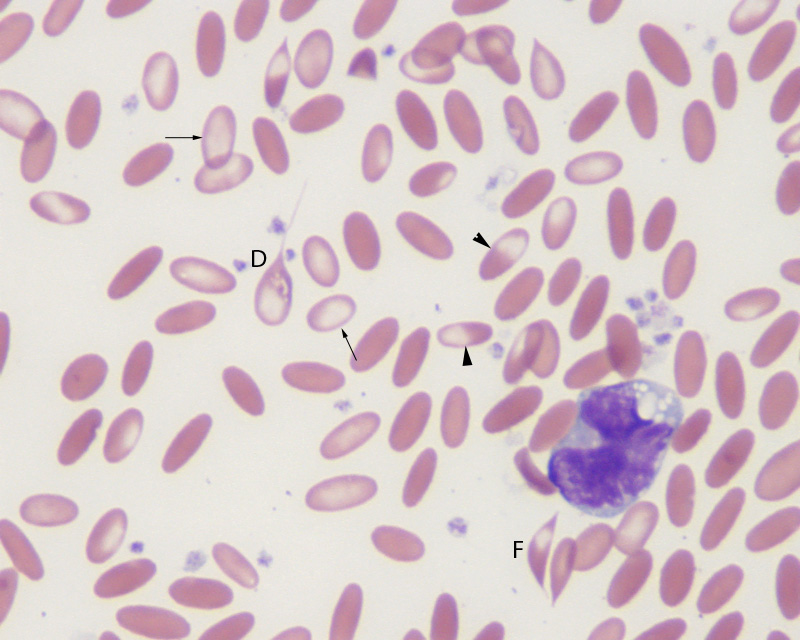
¿Cómo identificar la deficiencia de hierro?
La palidez de mucosas y un bajo crecimiento son indicadores de anémia pero para confirmar que su origen de deba realmente a una deficiencia de hierro necesitaremos al menos un frotis sanguíneo que la caracterize y el analisis de los niveles de hierro en sangre, saturación de transferritina o la concentración de ferritina.
Antes de evaluar los resultados de estos examenes tenemos que considerar que durante infecciones el hierro sérico baja y la ferritina aumenta, así como que la hipoproteinemia puede inducir falsos positivos (el resultado indica que hay deficiencia de hierro cuando en realidad no la hay).
Tratamiento y control
Dependiendo de la severidad se puede indicar la suplementación de hierro en el alimento, la aplicación de hierro dextrano inyectable o transfuciones sanguineas. La dosificación recomendada ronda los 150mg por cría con un intervalo de 2 a 3 semanas.
En la mayoría de casos la deficiencia de hierro sólo requerirá la suplementación de la dieta, evitando que la fuente provenga del óxido férrico ya que este no es asimilable. La mayoría de forrajes y suplementos comerciales contienen suficiente hierro para alcanzar o superar los requerimientos en estas especies.
Deficiencia de Selenio
El selenio juega un papel importante como antioxidante al ser co-factor del glutation peroxidasa, enzima que forma parte del sistema antioxidante que reduce el daño tisular por la explosión de superóxido u otros mecanismos de generación de radicales libres.
La acción del selenio se complementa con la de la vitamina E y la deficiencia de cualquiera de estos se compensa parcial o completamente en abundancia del otro. La enfermedad miodegenerativa con fibrosis muscular inducida por deficiencia de selenio es rara en camélidos sudamericanos pero puede sufrirla cualquier animal independientemente de su edad (aunque los jovenes son los que la expresan más amenudo).
La deficiencia de selenio se asocia principalmente a problemas reproductivos, tanto en las hembras (abortos espontaneos y nacidos muertos) como en los machos (baja calidad espermática).
¿Cómo identificar la deficiencia de selenio?
El diagnóstico se basa en la observación de signos clínicos y la determinación de su concentración en sangre, siendo los valores normales de 150 a 220 ng/ml y considerandose deficientes los valores menores a 120 ng/ml.
Similar a otras especies, los camelidos sudamericanos mantienen una concentración de 1 a 2.5mcg/g peso seco de selenio en sus higados pero recien se considera que sus niveles son deficientes al llegar estar por debajo de los 0.4 mcg/g.
Tratamiento y control
Las formas inorgánicas de selenio (selenito y selenato) son reducidas a selenio elemental o selenurios durante su pasaje por las cámaras fermentativas y se vuelven biológicamente inactivas. Por eso, los rumiantes y camélidos son más sensibles a las deficiencias nutricionales de selenio.
En casos graves se recomienda la suplementación parenteral a una dosis de 55 µg/kg de peso. Por otro lado, la suplementación oral es el metodo de elección para evitar su deficiencia y en ella se prefieren las fuentes organicas como las de selenio-metionina.
Es importante que las madres tengan buenos niveles de selenio durante la gestación porque este es transferido y acumulado al higado de las crias que, por el bajo contenido de selenio en la leche, dependerán de sus reservas para mantener niveles apropiados hasta que puedan consumir forrajes.
Deficiencia de Zinc
El zinc está involucrado en casi todos los aspectos del metabolismo, desde la señalización celular hasta la performance reproductiva. Son más de 200 metaloenzimas que lo requieren y su deficiencia resulta en cuadros clínicos que se manifiestan con anorexia, bajo crecimiento, desordenes músculo-esqueléticos, bajos indices reproductivos y desórdenes del sistema tegumentario (Suttle, 2010).
La biodisponibilidad del zinc se reduce en presencia de un exceso de cobre y calcio en la dieta, mientras que su deficiencia altera la sintesis de la proteína ligadora de retinol que causará bajos niveles de vitamina A plasmática.
Los animales que se alimentan de forrajes con una bajo nivel de zinc (<25ppm) requerirán de suplementación de este mineral y sin ella se podrá esperar el aumento de la incidencia de lesiones cutaneas que serán más notorias en las zonas desprovistas de fibras como el abdomen, axilas, las porciones mediales de los muslos y la región inguinal.
Las lesiones de este tipo caracterizan por un engrosamiento de la piel con una costra fuertemente adherida e histológicamente se describen como hiperqueratosis paraqueratósicas (Rosychuk, 1994). Los animales con fibras de color parecen ser más suceptibles a esta condición (Clauss et al., 2004).
¿Cómo identificar la deficiencia de zinc?
Las lesiones de piel son un indicador, pero debemos descartar primero la presencia de ectoparásitos. Para confirmar la deficiencia se puede medir la concentración de zinc en el suero o de una biopsia de higado, cualquiera de los dos metodos es igual de efectivo.
Si escojemos la toma de muestra de sangre deberemos usar tubos especiales para colección de minerales ya que los tubos Vacutainer® con tapones de caucho utilizan lubricantes a base de zinc y pueden contaminar la muestra (elevando artificialmente su concentración). Otro punto a considerar es que el zinc sérico puede reducirse fisiológicamente durante los procesos inflamatorios (Herdt y Hoff, 2011).
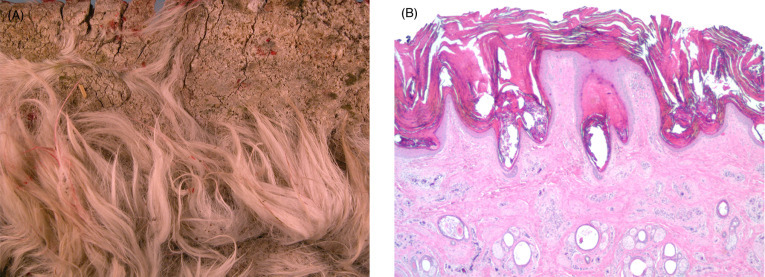
Tratamiento y control
Muchas patologías de la piel parecen responder al tratamiento con zinc sin embargo podría necesitarse una biopsia para asegurarnos que el problema no se deba a ectoparásitos. Los camélidos sudamericanos requieren un alimento con 45 a 60 ppm de zinc en base a la materia seca pero puede ser más en presencia de niveles altos de calcio y cobre.
La suplementación durante cuadros clínicos debe ser de al menos de 1 gramo diario de sulfato de zinc (36.3% de zinc) o de 2 a 4 gramos de zinc-metionina (10% de zinc). Para el mantenimiento 1 gramo de zinc-metionina parece ser suficiente como preventivo en poblaciones susceptibles.
La fuente de preferencia es el zinc-metionina ya que su disponibilidad sería mejor en presencia de otros agentes que interfieran con su absorción. Una vez iniciado el tratamiento, la recuperación es paulatina y puede requerir de 2 a 3 meses.
Enfermedades por exceso de minerales
Exceso de potasio
El exceso de potasio es común en pastos fertilizados y predispone a la deficiencia de magnesio, además induce una sobrecarga catiónica que debe ser compensada por los riñones. Esto resulta en la excreción de una orina con pH elevado (> 8.0).
La elevación crónica del pH urinario contribuye en la formación y precipitación de urolitos que son una causa común de urolitiasis y obstrucciones en camelidos y rumiantes machos (que están en mayor riesgo por el diametro de su uretra y la flexura sigmoidea)
Los signos clínicos en animales con obstrucción urinaria dependen del grado de obstrucción. Si la obstrucción es completa, la presión retrograda se acumula en la vejiga hasta el punto que se rompe y produce la muerte del animal, esto ya ha sido reportado en camélidos (McLaughlin y Evans 1989, Dart et al., 1997). Si el bloqueo es incompleto se podrán observar diferentes niveles de estranguria y hematuria, estos animales muestran signos de dolor, bruxismo y letargia.
Tradicionalmente se lograba acidificar el pH urinario con la suplementación de cloruro de amonio a razón de 5 a 10 g/kg de materia seca en el alimento. Actualmente existen otros suplementos mucho más palatables pero existe poca información acerca de su seguridad y eficacia en camelidos sudamericanos.
Intoxicación por sulfuros
El exceso de sulfuro interfiere con la absorción de cobre y el sulfuro hace que el selenio inorgánico no sea asimilable. Un alto consumo de sulfatos puede inducir polioencefalomalacia que no responde a la suplementación con tiamina. Aunque no se hayan reportado casos confirmados en camélidos existe el riesgo en los que son alimentados en confinamiento con dietas altas en granos.
Intoxicación por cobre
Se trata de la hepatotoxicosis mineral más común en camélidos sudamericanos. Su origen generalmente es iatrogénico, por el desconocimiento de la baja tolerancia de estos animales comparandolos con aves, bovinos y equinos.
Los signos clínicos de esta intoxicación incluyen la anorexia, disena, letargia, debilidad y postramiento con una muerte despues de 2 días. Su diagnóstico requiere una biopsia ya que los niveles en sangre no se elevan hasta que la intoxicación está avanzada y los animales no sufren de la clásica crisis hemolítica (hemoglobinuria, hemoglobinemia, hiperbilirrubinemia e ictericia) que otras especies presentan.
Anatomopatológicamente las lesiones se limitan a una hepatomegalia discreta, sin el decoloramiento de los riñones u otros organos como sucede en los rumiantes. Histológicamente la necrosis hepatocelular se extiende por todo el higado y será posible ver pigmentos intracelulares al usar la tinción de rodamina.
Si se sospecha de una intoxicación aguda, se pueden usar inhibidores de absorción o quelantes: molibdenato (1 a 1.5 mg/kg), sulfato de sodio (10 a 15 mg/kg) o penicillamina (25 a 50 mg/kg) por 5 a 7 días. La ventaja de la penicilamina es que permite la remoción gradual del cobre en el higado, sirviendo tambien para tratar cuadros de intoxicación crónicos.
Los animales que sobreviven la fase aguda y muestran signos de mejora generalmente sobreviven pero algunos no se recuperan del daño hepático y su salud queda comprometida de por vida.
Si hay sospechas de un exceso de cobre en las dietas se puede monitorear el estatus de la manada tomando biopsias de higado de todos los animales que mueren o de un grupo significativo.
Intoxicación por selenio
El margen de seguridad del selenio es muy estrecho, las dietas deben contener al menos 0.1ppm pero no más de 2ppm. El uso inapropiado de productos inyectables que contienen selenito de sodio (cuya biodisponibilidad es muy buena) suele ser la causa de intoxicaciones en regiones donde la deficiencia es prevalente.
El exceso de selenio interfiere con la oxidación celular y las reacciones de reducción. Los animales afectados muestran disnea, taquipnea, sialorrea, taquicardia y colapso cardiovascular unos minutos u oras despues de la inyección de una cantidad excesiva de selenio o el consumo de plantas conocidas por su exceso de selenio.
No existe antidoto, el tratamiento es sintomatico y la deficiencia de cobre puede exacerbar la selenosis crónica. La prevención se basa en el uso apropiado de suplementos, respetando las dosificaciones recomendadas.
Enfermedades asociadas a Vitaminas
Polioencefalomalacia (cerebral cortical necrosis)
Frecuentemente asociado a la deficiencia de tiamina (vitamina B1) por cambios bruscos en la dieta que estimulen la proliferación de bacterias productoras de tiaminasa. La poliencefalomalacia tambien puede desencadenarse por el uso de algunos antiparasitarios como el amprolio.
Macroscópicamente, la corteza cerebral presentará una tumefacción difusa y moltifocal en la materia gris superficial y en ocaciones se extenderá hacia la materia blanca subyacente. Destaca que las áreas de tejido necrótico decolorado autoflorescen bajo la luz ultravioleta (Figura 4).
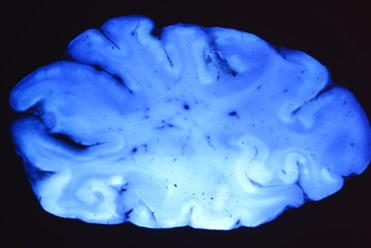
Histologicamente, la gliosis, necrosis laminar (en las láminas más profundas) y edema en las láminas superficiales son hallazgos caracteristicos. La necrosis es más común en el cerebro pero tambien puede encontrarse en el cerebelo. Lesiones crónicas pueden contener cavidades quisticas (Kiupel et al., 2003; Whitehead and Bedenice, 2009).
Deficiencia de Vitamina D
Los camelidos pueden desarrollar musculoesqueléticos secundarios a la hipofosfatemia y uno de los factores que contribuye a estos desbalances es la falta de vitamina D.
La vitamina D es necesaria para la absorción de calcio y fosforo en el intestino, la reabsorción de calcio en los riñones y la formación y mineralización de los huesos. La falta de vitamina D resulta en la promoción de la actividad de la paratohormona que mobiliza el calcio del hueso y lo retiene para mantener su homeostasis en la sangre.
Estos eventos son más severos en camelidos jovenes y en desarrollo ya que los adultos suelen tener una osificación suficientemente mineralizada para sobrepasar temporadas sin mostrar sintomatología clínica.
El raquitismo produce el ensanchamiento y fracaso de la osificación de la placa de crecimiento, particularmente del radio distal o la tibia (Figura 5). Deformidades angulares, adelgazamiento de la corteza y fracturas patológicas pueden tener otras etiologías, pero todas se han relacionado con este síndrome.
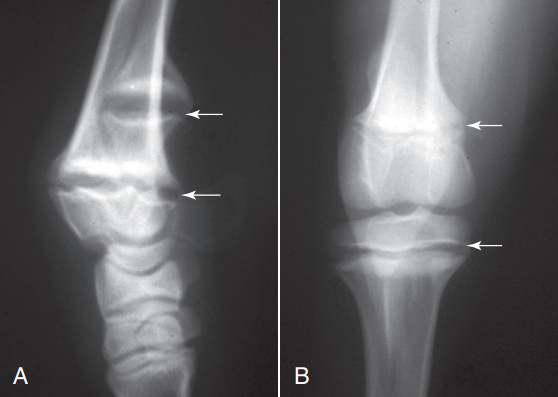
La evidencia que sugiera animales en riesgo o afectados por raquitismo puede corroborarse determinando los niveles de fosforo (< 2 mg/dl) y la concentración de vitamina D (< 50 mmol/L).
Debido al retraso entre las anormalidades sanguineas y la debilidad del hueso, la suplementación de los animales con niveles bajos prevendrá la aparición de signos clínicos.
Intoxicación por vitamina D
Hay un rango muy estrecho entre los requerimientos y la toxicidad por vitamina D aunque las inyecciones de vitamina D a dosis de 8000 a 64000 UI/kg peso vivo no inducen signos de toxicidad aguda.
En esta especie se reporta hiperfosfatemia (> 2.9 mmol/L [> 9 mg/dL]) secundaria al exceso de vitamina D pero no hipocalcemia, incluso a una dosis mayor a 16000 UI/kg.
La recomendación para crias es de 1000 a 2000 UI/kg y aseguran suficiencia por más de 90 días. Aumentar la dosis por encima de ese esos niveles no trae un beneficio clínico ni económico.
Deficiencia de vitamina E
Se asocia a la falta de forraje fresco y está muy relacionada con la deficiencia de selenio. La patología más común que a la que predispone la deficiencia de vitamina E en camelidos sudamericanos es la degeneración neuronal pero en niveles de deficiencia marginales se presentan principalmente problemas reproductivos.
La vitamina E no cruza la placenta de manera eficiente por lo que los tuis nacen con niveles bajos y dependerán del estatus de vitamina E de sus madres mientras estén lactando.
¿Cómo identificar la deficiencia de vitamina E?
Se puede diagnosticar midiendo los niveles de α-tocoferol en suero o higado. Niveles de 1.5 mcg/ml son considerados adecuados.
Tratamiento y control
Inyecciones a dosis de 5 a 19 UI/kg (3.7 a 7.5 mg/kg) cada 3 semanas permiten reestablecer los niveles de vitamina E a niveles referenciales (Van Saun y Cebra, 2014). Animales que esten consumiendo pastos frescos no suelen requerir una suplementación extra de esta vitamina. Las recomendaciones nutricionales para camelidos sudamericanos son:
- Mantenimiento: 5.3 mg/kg
- Hembras gestantes: 5.6 mg/kg
- Animales en crecimiento: 10mg/kg
Concluciones
La literatura referente a los problemas nutricionales en camélidos sudamericanos es escasa, sin embargo los reportes publicados y la evidencia clínica empírica sugieren que las llamas y alpacas comparten riesgos relativos a la deficiencia y toxicidad.
Las diferencias en su metabolimo los hacen más susceptibles a la lipidosis hepática, enfermedades asociadas a la vitamina D y deficiencia de zinc. Además, dada su mayor eficacia fermentativa, son más sensibles a los cambios bruscos de dietas que otros poligastricos.
Un mejor entendimiento de los requerimientos nutricionales y el metabolismo de estos animales nos permitirá desarrollar mejores estrategias para la prevención y tratamiento de las enfermedades asociadas a su alimentación.
Aún nos quedan temas por hablar como la acidosis del primer compartimento, intoxicaciones por plantas y suplementos pero eso lo conversaremos más adelante.
Gracias por leer este artículo, si les gustó no duden en compartirlo en sus redes y escribir sus opiniones en la sección de comentarios. Hasta una nueva oportunidad.
Bibliografía
- Agnew D. Camelidae. Pathology of Wildlife and Zoo Animals. 2018:185–205.
- Carmalt JL. Protein-energy malnutrition in alpacas. Comp for Cont Ed for Pract Vet 2000;22(12):1118–24
- Cebra CK, Garry FB, Getzy DM, et al. Hepatic lipidosis in anorectic, lactating Holstein cattle: a retrospective study of serum biochemical abnormalities. J Vet Intern Med 1997;11(4):231–7.
- Cebra CK, Tornquist SJ, Jester RM, et al. Assessment of the effects of feed restriction and amino acid supplementation on glucose tolerance in llamas. Am J Vet Res 2004;65(7):996–1001.
- Clauss M, Lendl C, Schramel P, Streich WJ. Skin lesions in alpacas and llamas with low zinc and copper status–a preliminary report. Vet J. 2004 May;167(3):302-5. doi: 10.1016/S1090-0233(03)00122-9.
- Herdt TH, Hoff B: The use of blood analysis to evaluate trace mineral status in ruminant livestock, Vet Clin North Am: Food Anim Pract 27(2):255-283, 2011.
- Keane D, Newsholme P. Saturated and unsaturated (including arachidonic acid) non-esterified fatty acid modulation of insulin secretion from pancreatic betacells. Biochem Soc Trans 2008;36(Pt 5):955–8.
- Kegley, E. B. & Spears, J. W. (1994) Bioavailability of Feed-Grade copper sources (oxide, sulfate or lysine) in Growing cattle. J. Anim. Sci. 72: 2728-2734
- Kiupel, M., VanAlstine, W., Chilcoat, C., 2003. Gross and microscopic lesions of polioencephalomalacia in a llama (Lama glama). Journal of Zoo and Wildlife Medicine 34, 309–313.
- Lopez, A., Maiztegui, J., Cabrera, R., 1998. Voluntary intake and digestibility of forages with different nutritional quality in alpacas. Small Rum. Res. 29, 295–301.
- Oetzel, G.R., 1988. Protein-energy malnutrition in ruminants. Vet. Clinics. N. A.: Food Anim. Pract. 4 (2), 317–330.
- Roden M. How free fatty acids inhibit glucose utilization in human skeletal muscle. News Physiol Sci 2004;19:92–6
- Rosychuk RAW: Llama dermatology, Vet Clin North Am:Food Anim Pract 10(2):228-239, 1994.
- Smith JA. Noninfectious diseases, metabolic diseases, toxicities, and neoplastic diseases of South American camelids. Vet Clin North Am Food Anim Pract 1989; 5(1):101–43
- Suttle NF: The mineral nutrition of livestock, ed 4, New York, 2010, CABI Publishing
- Tornquist SJ, Van Saun RJ, Smith BB, et al. Histologically-confirmed hepatic lipidosis in llamas and alpacas: 31 cases (1991–1997). J Am Vet Med Assoc 1999;214(9):1368–72.
- Underwood EJ, Suttle NF. The mineral nutrition of livestock. 3rd edition. New York: CABI Publishing; 1999. p. 614.
- Van Saun RJ. Feeding the alpaca. In: Hoffman E, editor. The complete alpaca book, 2nd edition. Santa Cruz (CA): Bonny Doon Press; 2003. p. 179–232
- Van Saun, R. J., & Cebra, C. (2014). Nutritional Diseases. Llama and Alpaca Care, 124–139. doi:10.1016/b978-1-4377-2352-6.00013-4
- Whitehead, C.E., Bedenice, D., 2009. Neurologic diseases in llamas and alpacas. Veterinary Clinics of North America Food Animal Practice 25, 385–405.





