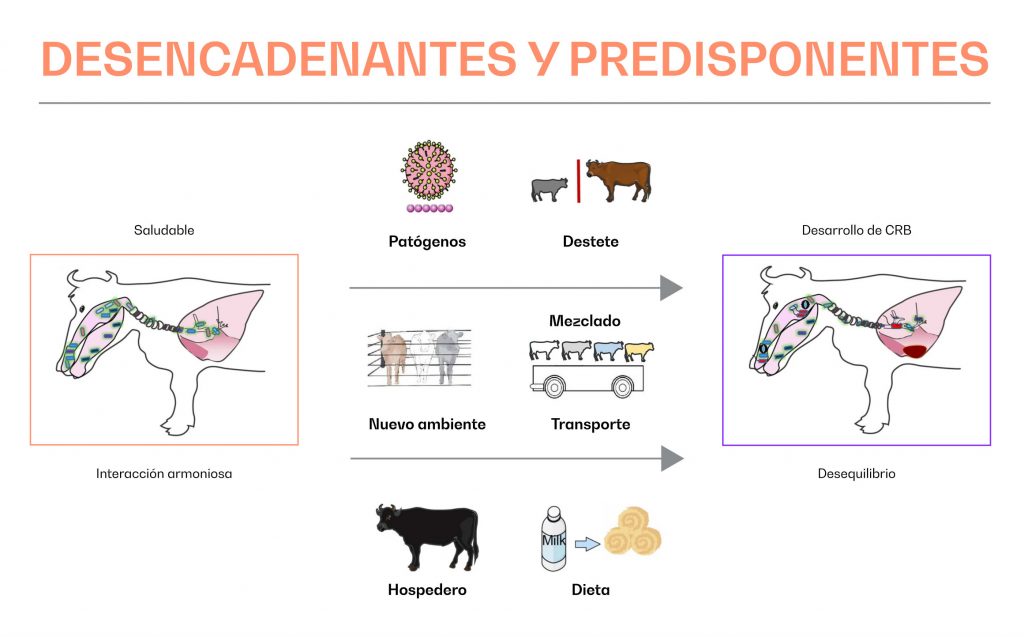
El complejo respiratorio bovino (CRB), también llamado enfermedad respiratoria bovina (ERB) es una de las enfermedades de mayor impacto económico sobre producción ganadera. La patogenia tradicionalmente aceptaba indicaba que una infección viral primaria debilitaría las defensas del hospedero y predispondría a infecciones bacterianas secundarias (Hodgson, 2005). Esta hipótesis, sin embargo, no siempre se cumple y sería una sobresimplificación que no considera el rol primario de algunos patógenos no reconocidos anteriormente (Murray et al., 2016).
Fisiopatología
La teoría actual respecto a la patogénesis del complejo respiratorio bovino considera que se trata de una interacción sinérgica entre bacterias y virus bajo la influencia de varios estresores a los que se les añade cambios en el hospedero y su ambiente (Snowder et al., 2006, Taylor et al., 2010).
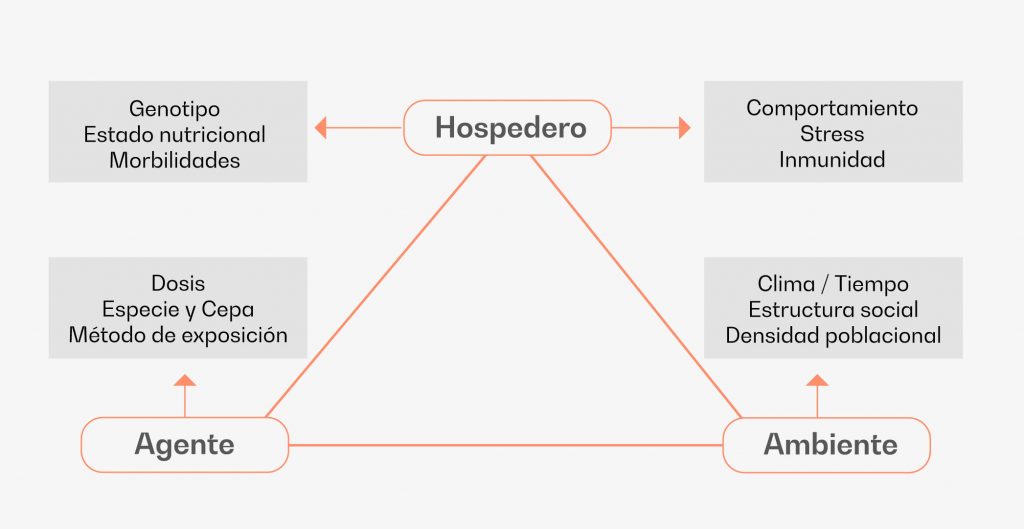
En la práctica podemos considerar que situaciones como el transporte, cambios en la dieta o alimentación, confinamiento, procedimientos quirúrgicos y hasta la alteración de la estructura social en los corrales (por la posterior inducción a peleas) genera un ambiente de alto estrés que predispone a la aparición del CRB (Urban-Chmiel y Grooms, 2012, Elshiekha et al., 2011).
Agentes involucrados en el CRB
Los agentes etiológicos implicados en la patogénesis de la enfermedad respiratoria bovina involucran virus, bacterias y parásitos, ya sean como agentes primarios o en combinación.
| Virus | Bacterias | Parásitos |
| Herpes virus bovino tipo 1 (BoHV-1) | Mannheimia haemolytica | Dictyocaulus viviparus |
| Virus Respiratorio Sincitial Bovino (VRSB) | Pasteurella multocida | |
| Virus de la parainfluenza bovina tipo 3 (VPI-3) | Histophilus somni (antes Haemophilus somnus) | |
| Virus de la diarrea viral bovina (VDVB) | Mycoplasma spp. | |
| Coronavirus Bovino (BCoV) | ||
| Adenovirus Bovino tipo 3 (BAdV-3) | ||
| Virus de la Influenza D (IDV) |
Sintomatología clínica
Los signos clínicos del CRB pueden variar en gran medida por la fase y extensión de la enfermedad, pero suelen incluir:
- Secreción nasal
- Disnea
- Taquipnea
- Fiebre
- Frecuencia cardiaca elevada
- Sialorrea
- Anorexia
- Tos
- Rinitis
- Posturas antiálgicas
Lamentablemente, la interpretación clínica tiene una sensibilidad y especificidad limitada, lo que puede resultar en un tratamiento innecesario, una detección retrasada o negativa del CRB en animales verdaderamente enfermos.
Se estima que la sensibilidad de detección de la CRB llevada a cabo por personal capacitado no supera el 65% cuando sólo se basa en los signos clínicos (White y Renter, 2009). Además, aunque la extensión de las lesiones pulmonares (p.e. adherencias pleurales, colapso/consolidación, fibrosis parenquimatosa, abscesos o enfisema) resultantes del CRB se asocian al riesgo de mortalidad y retratamiento, las lesiones se encuentran con frecuencia en el matadero, a menudo en terneros en los que nunca se detectó la enfermedad (Wittum et al., 1996, Schneider et al., 2009).
Repercusiones económicas
El CRB es la principal causa de morbilidad en centros de engorde y puede superar el 80% de los casos de animales enfermos. Cuando un animal no es tratado oportunamente el riesgo de que desarrollen lesiones que limiten su capacidad respiratoria, dañen su carcasa y reduzcan su productividad aumenta (Fernández et al., 2020).
Los animales con CRB clínica engordan 0.2 kg/día menos que un animal con CRB subclínica y el grado de marmoleo en su carcasa es significativamente menor (Schneider et al., 2009, Blakebrough-Hall et al., 2020).
Situación que nos obliga a buscar la manera de mitigar las causas a traves de medidas de control basadas en evidencia.
Medidas de control
Los sistemas de profilaxis y control del complejo respiratorio bovino son de gran ayuda para reducir pérdidas económicas pero deben considerarse sus limitantes. La investigación se esfuerza por abordar las deficiencias en el control del CRB, generando evidencia sobre el efecto de la inmunidad, la eficacia de las vacunas y el papel de la medicación masiva en el contexto del desarrollo de la resistencia antimicrobiana.
Vacunación
Aunque ampliamente aceptadas como una medida de control, las vacunas no siempre cuentan con evidencia que las respalde. Salvo en el caso de las vacunas contra el BHV-1 y la vacuna inactivada contra el BVDV, las vacunas no disminuyen el riesgo de morbilidad por CRB cuando se les compara con grupos no vacunados (Theurer et al. 2015).
Los errores de interpretación respecto a la eficacia de las vacunas se deberían en parte a la extrapolación de datos de estudios de desafío y no en los de eficacia en campo (Perino y Hunsaker, 1997).
Otro punto a considerar es el momento de vacunación respecto al reto infeccioso. La revisión sistematica de O’connor et al., 2019 nos indica que la vacunación a la llegada o cercana a la llegada del centro de engorde no reduce la incidencia del complejo respiratorio bovino.
Nutrición
Enfocada a los terneros que van a estar expuestos a condiciones de estres. Su alimento no sólo debe ser alto en energía y proteínas si no también proveer suficientes vitaminas y minerales. La suplementación inyectable en estos casos asegura que los animales no estén deficientes de micronutrientes y puedan responder mejor a un reto inmunológico.
Asegura que a tus animales no les falten micronutrientes, ya sean minerales como el Cu, Fe, Zn y Se o vitaminas como la A, D y E. Recuerda tambien que durante los cambios de dieta el rumen no será capaz de producir vitaminas del complejo B de manera eficiente así que consideralas tambien como parte de tu plan de suplementación a la llegada.
Mejores condiciones de transporte
Respetar los m2 por animal, durante el transporte los animales deben tener cierta libertad de movimiento. Existen formulas que permiten calcular rápidamente la cantidad de animales que podemos llevar en un determinado vehículo, entre ellas podemos mencionar las de Randall: A = 0.029 × W0,58 o Buchenauer A = 0.025 × W0,67 para viajes de menos de 4 horas (Randall, 1993, Tarrant, 1990).
Tambien se puede seguir la normativa Europea que considera 0.2 a 0.3m2 / 26 -55 kg peso vivo. (Unal et al., 2008). Conoce más de los beneficios economicos de cuidar el bienestar animal.
Reducción de la exposición
- Reduciendo el riesgo de ingreso de animales enfermos a la manada.
- Traer animales de los que se conozca que hayan manejado un programa de vacunación efectivo.
- No juntar directamente a los animales recien llegados con el resto (manteniendo un programa de cuarentena).
- Testear a los animales cuando sea posible.
- Aislar animales enfermos.
- Aplicar un programa de desinfección.
Metafilaxia
Definida por la Agencia Europea de Medicamentos (EMA) como el tratamiento de un grupo de animales sin evidencia de enfermedad cuando se encuentran en contacto con otros animales que tienen evidencia de una enfermedad infecciosa (EMA, 2016).
Consiste en la aplicación de antibióticos, especialmente de larga acción, a animales en alto riesgo de desarrollar CRB (p.e. a la llegada del centro de engorde). Su objetivo es reducir la incidencia aguda del CRB en terneros altamente estresados y se reporta que pueden reducir hasta en un 50% la morbilidad y en un 25% la mortalidad de los animales (Urban-Chmiel y Grooms, 2012).
Aunque el uso de antibióticos de forma masiva aumenta el riesgo de propagación de la resistencia a los antimicrobianos, estudios indican que su uso mediante programas de metafilaxia no aumentarían la cantidad total de antibióticos utilizados (Word et al., 2020). Incluso, esta estrategia trae claros beneficios para el bienestar animal y sobre los parámetros productivos iniciales.
Un reciente estudio de simulación nos da luces que la metafilaxia puede seleccionar la resistencia antimicrobiana contra el agente utilizado a la llegada, pero a la vez minimiza la selección de resistencia para otras drogas usadas en el tratamiento del complejo respiratorio bovino cuando se compara con grupos que no aplican la estrategia (Thompson, 2021).
Esto quiere decir que la ausencia de metafilaxia en terneros en alto riesgo que llegan a los centros de engorde puede resultar en una mayor incidencia de la enfermedad y el aumento del uso de antibióticos para el tratamiento terapéutico.
Aunque la práctica se aplique principalmente al control del complejo respiratorio bovino en el ganado cárnico, también se han reportado beneficios de su uso en terneras de reemplazo para la ganadería lechera (Stanton et al., 2010).
En Estados Unidos los antibióticos aprobados para el tratamiento metafiláctico son la tilmicosina, el florfenicol, la tulatromicina y el ceftiofour. Siendo la que ofrece mejores resultados la tulatromicina.
Esquemas metafilacticos comúnmente utilizados:
Un programa de metafilaxia puede usar los siguientes antibióticos a la llegada al centro de engorde:
- Ceftiofur (ácido libre): 6.6mg/kg
- Tilmicosina: 10 mg/kg
- Florfenicol: 40 mg/kg
- Tulatromicina: 2.5mg/kg
Cabe destacar que cuando la tulatromicina viene asociada a ketoprofeno, las propiedades antipiréticas del ketoprofeno se amplían notoriamente (De Koster et al., 2022).
¿Qué es la tulatromicina?
Es un agente macrólido semisintético que se origina de un producto de fermentación. Difiere de muchos otros macrólidos en que tiene una larga duración de acción, en parte es debida a sus tres grupos amino razón por lo que se le ha dado la designación química de subclase triamilida.
Es un agente bacteriostático que interfiere en la síntesis proteica al unirse con la subunidad ribosomal 50S de las bacterias, lo que estimula la disociación del peptidil-rRNA del ribosoma durante el proceso de traslocación ribosomal.
Posee actividad contra Mannheimia (antes Pasteurella), Actinobacillus pleuropneumoniae y Mycoplasma hyopneumoniae que son las bacterias patógenas más comúnmente asociadas a las enfermedades respiratorias del ganado bovino y porcino.
Propiedades farmacocinéticas de la Tulatromicina
Cuando se administra por vía subcutánea en bovinos a dosis única de 2,5 mg/kg de peso corporal, se absorbe rápidamente, logra una elevada distribución tisular y una tasa de eliminación lenta.
La concentración máxima (Cmax) en plasma es de 0,5 µg/ml y se alcanza 30 minutos después de la aplicación (Tmax). A las concentraciones pico le sigue una ligera disminución en la exposición sistémica con un tiempo de vida media de eliminación aparente (t½) de 90 horas en plasma.
La concentración en pulmón es considerablemente mayor que en el plasma. Así también, hay gran evidencia de acúmulo sustancial de tulatromicina en neutrófilos y macrófagos alveolares. Tras la administración subcutánea en ganado vacuno, la biodisponibilidad de la tulatromicina es de aproximadamente del 90%.
Bibliografía
- Blakebrough-Hall, C., McMeniman, J. P., & González, L. A. (2020). An evaluation of the economic effects of bovine respiratory disease on animal performance, carcass traits, and economic outcomes in feedlot cattle defined using four BRD diagnosis methods. Journal of animal science, 98(2), skaa005.
- De Koster, J., Boucher, J. F., Tena, J-K., Gehring, R., & Stegemann, M. R. (2022). Co-formulation of ketoprofen with tulathromycin alters pharmacokinetic and pharmacodynamic profile of ketoprofen in cattle. Journal of Veterinary Pharmacology and Therapeutics, 45, 69– 82.
- Earley, B., Buckham Sporer, K., & Gupta, S. (2016). Invited review: Relationship between cattle transport, immunity and respiratory disease. Animal, 11(03), 486–492.
- Elshiekha, HM. Major nematode infections. In: Elshiekha, HM, Khan, NA eds. Essentials of Veterinary Parasitology. Norfolk, UK: Caister Academic Press, 2011:37–69.
- European Medicines Agency. Guideline for the demonstration of efficacy for veterinary medicinal products containing antimicrobial substances. London, United Kingdom 2016.
- Fernández, M., Ferreras, M., Giráldez, F. J., Benavides, J., & Pérez, V. (2020). Production Significance of Bovine Respiratory Disease Lesions in Slaughtered Beef Cattle. Animals : an open access journal from MDPI, 10(10), 1770. https://doi.org/10.3390/ani10101770
- Frank, GH. Pasteurellosis of cattle. In: Adlam, CF, Rutter, JM eds. Pasteurella and Pasteurellosis. London, UK: Academic Press, 1989:197–218.
- Maunsell, FP. Mycoplasma bovis infections in cattle. J Vet Intern Med 2011;25:772–783.
- Panciera, RJ, Confer, AW. Pathogenesis and pathology of bovine pneumonia. Vet Clin North Am Food Anim Pract 2010;26:191–214.
- Panciera, RJ, Confer, AW. Pathogenesis and pathology of bovine pneumonia. Vet Clin North Am Food Anim Pract 2010;26:191–214.
- Schneider MJ, Tait RG, Busby WD, Reecy JM (2009) An evaluation of bovine respiratory disease complex in feedlot cattle: impact on performance and carcass traits using treatment records and lung lesion scores. J Anim Sci 87:1821–1827
- Snowder GD, Van Vleck LD, Cundiff LV, Bennett GL (2006) Bovine respiratory disease in feedlot cattle: environmental, genetic, and economic factors. J Anim Sci 84:1999–2008
- Taylor JD, Fulton RW, Lehenbauer TW, Step DL, Confer AW (2010) The epidemiology of bovine respiratory disease: what is the evidence for predisposing factors? Can Vet J 51:1095–1102
- Theurer, M.E., Larsen, R.L., White, B.J., 2015. Systematic review and meta-analysis of the effectiveness of commercially available vaccines against bovine herpesvirus, bovine viral diarrhea virus, bovine respiratory syncytial virus, and parainfluenza type 3 virus for mitigation of bovine respiratory disease complex in cattle. Journal of the American Veterinary Medicine Association 246, 126-142.
- Thompson, M. P. (2021). Agent-based modeling to address emerging threats from antimicrobial resistance to the sustainability of the beef industry (Doctoral dissertation, University of Saskatchewan).
- Urban-Chmiel, R., & Grooms, D. L. (2012). Prevention and control of bovine respiratory disease. Journal of Livestock Science, 3(3), 27-36.
- White BJ, Renter DG (2009) Bayesian estimation of the performance of using clinical observations and harvest lung lesions for diagnosing bovine respiratory disease in post-weaned beef calves. J Vet Diagn Invest 21:446–453
- Wittum TE, Woollen NE, Perino LJ, Littledike ET (1996) Relationships among treatment for respiratory tract disease, pulmonary lesions evident at slaughter, and rate of weight gain in feedlot cattle. J Am Vet Med Assoc 209:814–818
- Word, A. B., Wickersham, T. A., Trubenbach, L. A., Mays, G. B., & Sawyer, J. E. (2020). Effects of metaphylaxis on production responses and total antimicrobial use in high-risk beef calves. Applied Animal Science, 36(2), 265–270.





