La enfermedad quística ovárica (COD) o degeneración ovárica quística en el ganado lechero es una condición patológica que se caracteriza por la interrupción del ciclo reproductivo normal del ganado (anestro tipo III según la clasificación de Peter et al., 2009) y la presencia de una o más estructuras quísticas de un diámetro ≥ 20mm (Silvia et al., 2002, Vanholder et al., 2006).
Se estima que afecta entre el 5 y 25% de las vacas lecheras en lactación y que cada incidencia incrementa el intervalo entre partos de los animales afectados entre 22 y 64 días (Vanholder et al. 2006, Cattaneo et al. 2014, Lee et al. 1988, Borsberry y Dobson 1989).
Table of Contents
¿Cómo se originan los quistes ováricos?
En condiciones normales, después del reclutamiento de folículos antrales y un proceso de selección, un folículo continúa su desarrollo hacia folículo pre-ovulatorio sensible a la hormona leutinizante (LH) para ovular y liberar un ovocito fértil (Stassi et al., 2022).
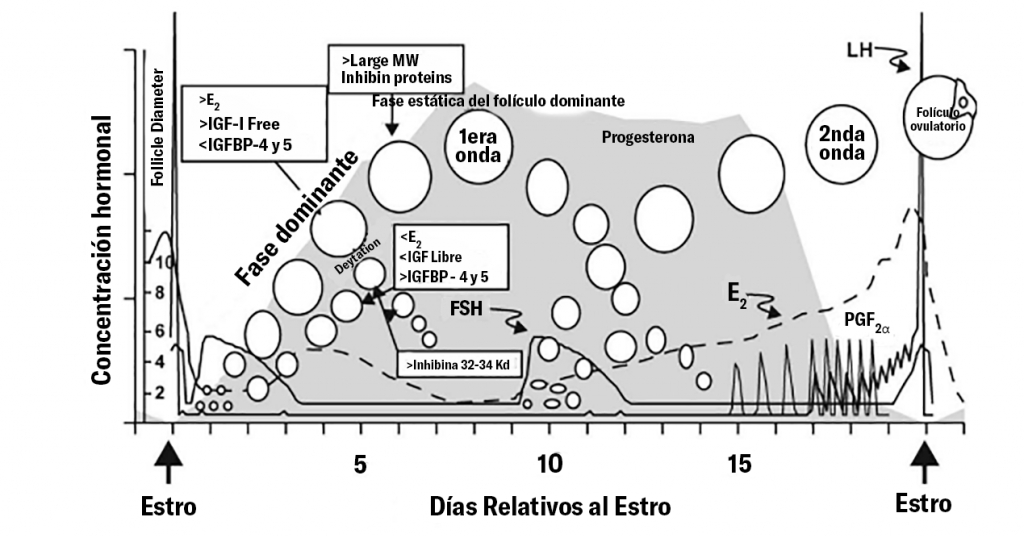
Como en la práctica no se suele determinar la temporalidad de un quiste y su detección puede darse sin evidencia de algún signo clínico, algunos autores prefieren utilizar la terminología de “Folículo ovárico quístico”* para evitar la connotación de enfermedad y porque permite diferenciarlo de otras estructuras quísticas que no tienen un origen folicular (p.e. tumores de las células de la teca y granulosa, quistes paraováricos y de la red ovárica) (Vanholder et al. 2006).
*En esta nota usaremos el termino quiste folicular para referirnos a los foliculos ovaricos quisticos para agilizar la lectura.
Formalmente, los quistes foliculares vendrían a ser los folículos preovulatorios que fallan en ovular, luteinizarse, regrecionar y continúan creciendo en el ovario. Su patogénesis aún no está completamente dilucidada pero podemos identificar 2 componentes que contribuyen a su formación:
- Defectos en el eje hipotalamico-pituitaria.
- Fallas intraovaricas.
Defectos en el eje hipotalamico-pituitaria
Los defectos hipotalámicos se dan por la falta de respuesta de estradiol para inducir la liberación de hormona liberadora de gonadotropina (GnRH) y la consecuente ausencia de un pico de hormona luteinizante (LH) por falta de estímulo hacia la glándula pituitaria (Todoroki y Kanekjo et al., 2006).
La insensibilidad del hipotálamo al estradiol en vacas con folículos ováricos quísticos puede explicarse por la presencia de concentraciones supra-basales pero sub-luteales de progesterona (P4) (0.1-1 ng/ml) que promueven la persistencia del folículo dominante alterando la amplitud, frecuencia y concentración de los pulsos de LH (Silvia et al., 2002, Hatler et al., 2003).
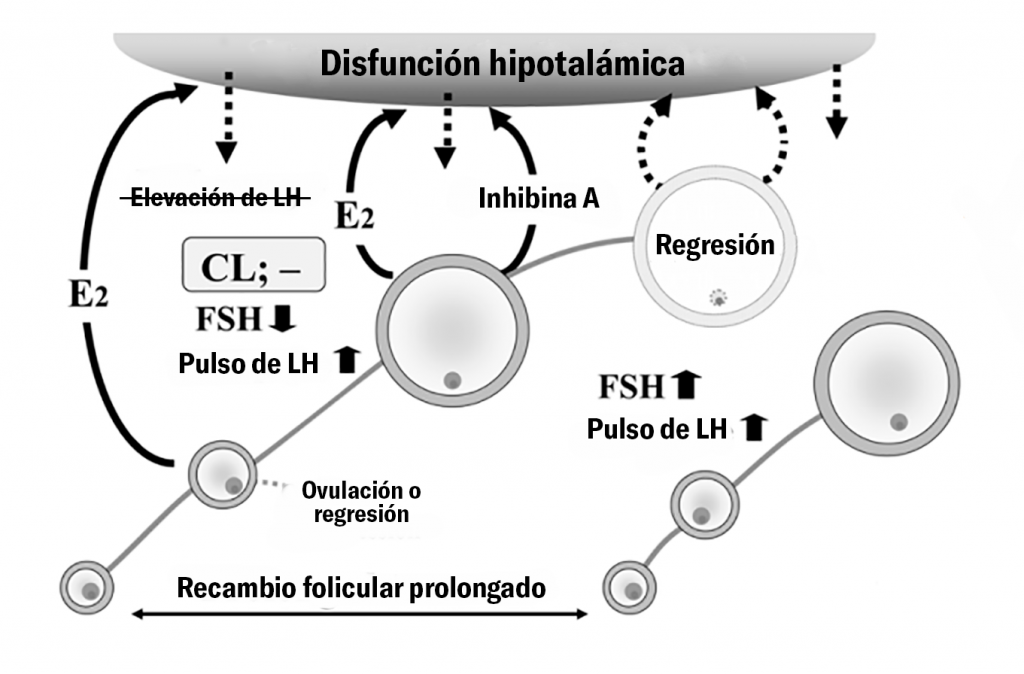
El origen de estos niveles de P4 podría ser adrenal y deberse a estímulos estresores que induzcan la liberación de hormona adrenocorticotrófica (ACTH) por las glándulas adrenales (Yoshida y Nakao, 2006, Ortega et al., 2015).
Fallas intraováricas
El componente intraovárico para la formación de quistes foliculares se debería a errores en la señalización en insulina y el desbalance en la expresión de proteínas del sistema de metaloproteasas de matriz/inhibidores tisulares de las metaloproteinasas (MMPs/TIMPs) en los quistes foliculares de los bovinos (Hein et al., 2015, Peralta et al., 2017).
Concretamente la disminución en la expresión de TIMP-2 que regula la remodelación tisular del folículo previa a su ovulación (Smith et al., 1996, Peralta et al., 2017).
Factores de riesgo
Las vacas de alta producción en sus 2 primeros meses de lactación son el grupo en mayor riesgo debido a que justamente son las que experimentan un balance energético negativo más marcado.
Se hipotetiza que la movilización de ácidos grasos no esterificados (NEFA) y su aumento en el líquido folicular podría generar un microambiente que comprometa la foliculogénesis y ovulación de las vacas (BorŞ y BorŞ, 2020).
Una alta producción láctea también se asocia al incremento en el consumo de alimento, lo que aumenta el flujo sanguíneo hepático, la tasa de metabolización de esteroides y reduce sus niveles circulantes (Wiltbank et al., 2006).
Otras condiciones comunes a la aparición de folículos ováricos quísticos son los desbalances minerales, los partos distócicos y los desórdenes en el puerperio como la retención de placenta, metritis y cetosis (Cockcroft et al., 2015, BorŞ y BorŞ, 2020). Se sabe además que el estrés de calor aumenta su riesgo en más de el doble
Clasificación
Durante el periodo de post parto la aparición de quistes ováricos es común y aunque muchas llegan a convertirse en estructuras inócuas para la reproducción, sigue siendo más rentable tratar todos los quistes antes de que puedan retrasar la ciclicidad de las vacas.
En terminos prácticos existen 2 tipos de quistes y cada uno tiene una respuesta distinta a tratamiento.
Quistes foliculares
Es la presentación inicial de la enfermedad, se define por la presencia de uno o más folículos ≥ a 20mm, la ausencia de estructuras luteales y la interrupción del ciclo estral. Estos pueden causar cuadros de hidrometra y mucometra, ninfomania y suelen asociarse a un tono uterino flácido y esponjoso.
Quistes luteales
Los quistes luteales se originan a partir de un quiste folicular en el que las celulas de la teca y granulosa espontaneamente se luteinizan y comienzan a producir P4 (Garverick, 1997). Son estructuras con paredes gruesas (más de 3mm) que muchas veces se confunden con cuerpos luteos cavitarios (una presentación normal de cuerpos lúteos).
Para diferenciarlos podemos guiarnos de los criterios ultrasonograficos de Kahn y Leidl:
- La laguna en los cuerpos lúteos cavitarios suele tener un diametro menor a 30 mm.
- La cavidad del quiste luteal suele ser regular y muchas veces se observan trabéculas (lineas blancas).
- En los cuerpos lúteos cavitarios el tejido luteal tiende a ser más grande que el de la cavidad.
- La laguna del cuerpo lúteo suele regresionar despues de 10 días.
Los signos clínicos asociados a estos quistes son los de masculinización y aciclidad.
Tratamiento
Históricamente las alternativas terapéuticas podían incluir técnicas como la ablación manual o la aspiración del líquido quístico, sin embargo, tienen desventajas que las hacen poco recomendables.
La técnica de ablación manual conlleva el riesgo de generar hemorragias y adherencias (Brito y Palmer, 2004). La aspiración de líquido quístico a pesar de ser una alternativa fácil y segura tiende a recidivar. (Dhara y Sharma et al., 2019).
Tanto los quistes luteales como foliculares responden al tratamiento con GnRH, sin embargo, se logra una mejor respuesta con PGF2𝛼 en los quistes luteales. No se debe intentar inseminar a la vaca con la ovulación resultante de un quiste y una buena práctica es aplicar PGF2𝛼 10 días despues si se encuentra un cuerpo lúteo.
Cuando la detección de estos quistes es cercana a los 50 días en leche, se recomienda iniciar un tratamiento de inseminación a tiempo fijo, ya sea Ovsynch u Ovsynch con dispositivos intravaginales de P4.
Estrategias de control
Los esfuerzos deben centrarse en reducir los problemas metabólicos en el periparto a través de un buen manejo de la vaca de transición, la modificación de las dietas hacia raciones insulogénicas y la reducción del estrés durante el post parto (Mimoune et al., 2021).
Otra medida que ayudaría en la reducción de la incidencia de quistes foliculares sería la aplicación de GnRH durante el post parto temprano para reiniciar la ciclicidad ovárica.
Para recibir este tratamiento, recomendamos incluir sólo a las vacas con folículos de más de 10mm (lo que sucederá alrededor de los 15 días en leche) ya que antes su capacidad para responder a la hormona no será la adecuada (Gümen y Seguin 2003).
Conclusiones
De esta condición debemos recordar que:
- La formación de quistes ováricos es un fenómeno complejo que tiene consecuencias económicas significativas para la ganadería lechera.
- Un diagnóstico certero ayudará a elegir el tratamiento con mayor probabilidad de éxito, pero no siempre será posible.
- El tratamiento de elección contra quistes foliculares son las inyecciones con análogos de la GnRH (p.e buserelina).
- El tratamiento de elección contra quistes luteales son las inyecciones con análogos de la PGF2𝛼 (p.e cloprostenol).
Si te gustó esta nota compártela en tus redes, déjanos tu opinión en la sección de comentarios y recuerda que Agrovet cuenta con los tratamientos hormonales que buscas en su tienda en línea. No esperes más y reduce el intervalo entre partos para lograr la mayor rentabilidad de tu ganado.
Hasta una nueva oportunidad.
También te puede interesar: 10 Pasos para mejorar el desempeño reproductivo de tu ganado
Bibliografía
- BorŞ, S. I., & BorŞ, A. (2020). Ovarian cysts, an anovulatory condition in dairy cattle. The Journal of veterinary medical science, 82(10), 1515–1522.
- Brito L. F. C., Palmer C. W.2004. Cystic ovarian disease in cattle. Large. Anim. Vet. Rounds 4: 1–6.
- Cockcroft, P. (Ed.). (2015). Bovine medicine. John Wiley & Sons.
- Dhara, S., Sharma, M. (2019). Cystic Ovarian Disease in Dairy Cow. Theriogenology Insight, 9(1), 23-30.
- Gümen, A., & Seguin, B. (2003). Ovulation rate after GnRH or PGF2α administration in early postpartum dairy cows. Theriogenology, 60(2), 341–348.
- Hatler T. B., Hayes S. H., Laranja da Fonseca L. F., Silvia W. J. 2003. Relationship between endogenous progesterone and follicular dynamics in lactating dairy cows with ovarian follicular cysts. Biol. Reprod. 69: 218–223.
- Hein, G. J., Panzani, C. G., Rodríguez, F. M., Salvetti, N. R., Díaz, P. U., Gareis, N. C., … & Rey, F. (2015). Impaired insulin signaling pathway in ovarian follicles of cows with cystic ovarian disease. Animal reproduction science, 156, 64-74.
- Iacono, E., Lucci, M., Mari, G., & Merlo, B. (2019). Luteal Blood Flow and progesterone concentration during first and second postpartum estrous cycle in lactating dairy cows. Reproduction in domestic animals = Zuchthygiene, 54(10), 1341–1347.
- Moore, K., & Thatcher, W. W. (2006). Major advances associated with reproduction in dairy cattle. Journal of Dairy Science, 89(4), 1254-1266.
- Ortega, H. H., Marelli, B. E., Rey, F., Amweg, A. N., Díaz, P. U., Stangaferro, M. L., & Salvetti, N. R. (2015). Molecular aspects of bovine cystic ovarian disease pathogenesis. Reproduction, 149(6), R251-R264.
- Peralta, M. B., Baravalle, M. E., Belotti, E. M., Stassi, A. F., Salvetti, N. R., Ortega, H. H., Rey, F., & Velázquez, M. (2017). Involvement of Matrix Metalloproteinases and their Inhibitors in Bovine Cystic Ovarian Disease. Journal of comparative pathology, 156(2-3), 191–201.
- Savio JD, Thatcher WW, Badinga L, de la Sota RL, Wolfenson D. Regulation of dominant follicle turnover during the oestrous cycle in cows. J Reprod Fertil 1993, 97:197-203
- Silvia WJ, Hatler TB, Nugent AM & Laranja da Fonseca LF. 2002. Ovarian follicular cysts in dairy cows: an abnormality in folliculogenesis. Domestic Animal Endocrinology 23 167–177.
- Stassi, A. F., Díaz, P. U., Gasser, F. B., Velázquez, M. M. L., Gareis, N. C., Salvetti, N. R., … & Baravalle, M. E. A review on inflammation and angiogenesis as key mechanisms involved in the pathogenesis of bovine cystic ovarian disease. Theriogenology, 186, 70-85.
- Todoroki, J., & Kaneko, H. (2006). Formation of follicular cysts in cattle and therapeutic effects of controlled internal drug release. Journal of Reproduction and Development, 52(1), 1-11.
- Vanholder, T., Opsomer, G., & De Kruif, A. (2006). Aetiology and pathogenesis of cystic ovarian follicles in dairy cattle: a review. Reproduction Nutrition Development, 46(2), 105-119.
- Vasconcelos, J. L. M., Sartori, R., Oliveira, H. N., Guenther, J. G., & Wiltbank, M. C. (2001). Reduction in size of the ovulatory follicle reduces subsequent luteal size and pregnancy rate. Theriogenology, 56(2), 307-314.
- Wiltbank, M., Lopez, H., Sartori, R., Sangsritavong, S., & Gümen, A. (2006). Changes in reproductive physiology of lactating dairy cows due to elevated steroid metabolism. Theriogenology, 65, 17–29
- Yoshida C, Nakao T. Plasma cortisol and progesterone responses to low doses of adrenocorticotropic hormone in ovariectmized lactating cows. Journal of Reproduction and Development 2006; 52:797–803.





