La anaplasmosis es una enfermedad causada por las bacteria del género Anaplasma, y aunque puede afectar a otros rumiantes, es más notorio en el ganado (1). Se transmite principalmente mediante la picadura de las garrapatas y es una de las mayores causas de preocupación en el ganado bovino infestado tanto de carne como de leche debido a que esta enfermedad es causa de mortalidad.
Table of Contents
Etiología
La anaplasmosis bovina resulta principalmente de la infección con Anaplasma marginale perteneciente al género Anaplasma y la familia Anaplasmataceae. Existen otras especies del género como Anaplasma centrale y Anaplasma ovis el cual no es infeccioso en el ganado bovino. Esta bacteria Gram negativa es intraeritrocítica obligada y se encuentra dentro de vacuolas unidas a membranas en el citoplasma de las células huésped (2). La interacción de Anaplasma marginale con las células del hospedero se da gracias a las principales proteínas de superficie de la bacteria por lo que tienen un papel importante en la infección (1).
Epidemiología
La anaplasmosis se presenta alrededor del mundo en las regiones tropicales y subtropicales y es un problema mayor en las producciones de diversos países de Europa, Asia, África y América. Es endémica en la mayoría de los países de Latinoamérica con excepción de las áreas desérticas o montañosas. Debido al cambio climático, la distribución de las garrapatas puede cambiar, por lo que podrían encontrarse en nuevos lugares (1) (3).
La transmisión de A. marginale de forma mecánica se da normalmente por moscas mordedoras o sangre contaminada por fómites y de forma biológica por garrapatas. Se ha reportado transmisión mecánica por artrópodos como Tabanus, Stomoxys, y mosquitos y en fómites como agujas, sierras de descorne e instrumentos para tatuar y castrar (3).
Esta transmisión mecánica depende directamente del nivel de A. marginale en la sangre al momento de que el vector mecánico se alimenta o los fómites tienen contacto con la sangre, por lo que se presume que la transmisión mecánica solo es posible en la fase aguda cuando los niveles de infección están en su punto más alto (4).
Se conocen alrededor de 20 especies de garrapatas como vectores de A. marginale alrededor del mundo (1). En el Perú, la garrapata Boophilus microplus es la de mayor importancia, sobre todo en la zona selva (5).
La transmisión de A. marginale también puede transmitirse de la vaca al ternero por vía transplacentaria durante la gestación. Por lo tanto, tiene un papel importante en la epidemiología de la enfermedad, principalmente en los países donde la enfermedad es endémica (1) (3).
El ganado de todas las edades puede infectarse con A. marginale, pero la gravedad de la enfermedad va a depender de la edad del animal. Los terneros son menos susceptibles a presentar la enfermedad clínica. Una muestra de esto es que los casos en terneros menores a los 6 meses de edad son raros.
Los animales entre 6 meses a 1 año pueden presentar enfermedad leve. Cuando tienen entre 1 a 2 años es más probable que sufran la enfermedad aguda pero rara vez es fatal. Sin embargo, en bovinos adultos mayores de 2 años, la enfermedad es aguda y frecuentemente fatal con un rango de mortalidad que puede ir entre 29% a 49% (1). Esto se debe a la inmunidad pasiva proveída por el calostro y la temprana infección de los terneros. Cuando los terneros se infectan, la inmunidad resultante es mantenida cuando son adultos a través de las reinfecciones, sin presentar signos clínicos de la enfermedad (6).
Fisiopatología
Luego de la infección inicial y el periodo de incubación que puede ser de 7 a 60 días, Anaplasma marginale invade los eritrocitos y se replica constantemente formando cuerpos de inclusión (Figura1). Luego de que los eritrocitos infectados son eliminados por el sistema reticuloendotelial, invade otros eritrocitos continuando la infección. La cantidad de eritrocitos parasitados en la fase aguda de la infección puede ir del 10% al 90% dependiendo de la cepa de Anaplasma y la susceptibilidad del huésped (1).
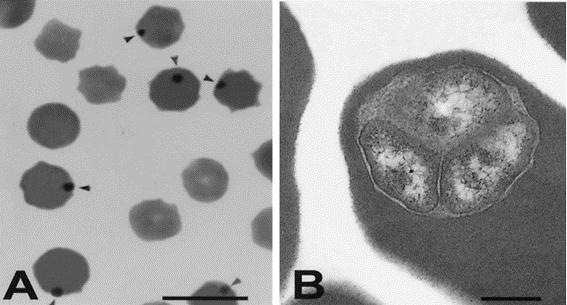
Figura 1: Eritrocito de bovino infectado con A. marginale. A) Cuerpos de inclusión en la perfiferia del eritrocito señalados. B) Cuerpos de inclusión en micrografía electrónica conteniendo tres organismos.
Fuente: Corona et al., Anaplasmosis bovina (bovine anaplasmosis) (2005).
La enfermedad clínica se manifiesta cuando al menos un 15% de los eritrocitos están parasitados y se presenta como anemia hemolítica e ictericia sin hemoglobinemia ni hemoglobinuria debido a que el sistema reticuloendotelial fagocita los eritrocitos infectados (1). Otros signos que normalmente se presentan son fiebre que puede llegar a temperaturas de 41ºC, anorexia, depresión, debilidad muscular, acidosis severa, aborto y muerte (1) (6).
Luego de la fase aguda, la parasitemia disminuye drásticamente en los animales sobrevivientes y se desarrolla una respuesta regenerativa a la anemia (6). Los animales infectados, hayan desarrollado enfermedad clínica o no, permanecen como portadores por el resto de su vida (1).
Una vez recuperado el ganado, permanecen como portadores con infección persistente con fluctuaciones de periodos de 10 a 14 días aproximadamente en los que el número de eritrocitos circulantes infectados con Anaplasma marginale asciende y desciende (1) (6).
Diagnóstico
El diagnóstico de la anaplasmosis bovina se puede hacer mediante frotis de sangre con tinción Giemsa con el objetivo de detectar al A. marginale. Sin embargo, esta técnica solo es confiable en la fase aguda de la enfermedad, ya que en animales presintomáticos y portadores el nivel de parasitemia no es lo suficientemente alto para ser detectado mediante la tinción (1) (6).
El método diagnóstico que se considera el estándar de oro para la detección de animales infectados con A. marginale, incluso en los que tienen infección persistente consiste en la subinoculación de la sangre del animal sospechoso en un ternero esplenectomizado que es altamente susceptible a la infección. Si el donante está infectado se observará A. marginale en los frotis de la sangre del ternero esplenectomizado aproximadamente a las 4 semanas, aunque este periodo puede extenderse hasta las 8 semanas (1). Sin embargo, este método es poco práctico, costoso y conlleva problemas de bienestar animal, ya que los terneros enferman gravemente y tienen que ser eutanasiados. Adicionalmente, este método proporciona poca información sobre los niveles de parasitemia (1) (6).
La prueba serológica más precisa para identificar el ganado infecto con A. marginale es el ELISA competitivo (cELISA) el cual utiliza un anticuerpo monoclonal (MAb) específico para la proteína de superficie MSP5. Este método detecta específicamente la presencia de anticuerpos séricos que tienen como objetivo al MSP5 del A. marginale. Sin embargo, una limitante es la poca sensibilidad de la prueba para la detección de infecciones tempranas (1).
La prueba de fijación del complemento ha sido ampliamente usada por varios años. Sin embargo, tiene una sensibilidad muy variable (20%a 60%) y falla en detectar una cantidad significativa del ganado portador y en infecciones tempranas. Su uso continuo puede ocasionar que animales con infección persistente se les considere como negativos y sean introducidos en poblaciones sanas (1).
Los métodos de reacción en cadena de la polimerasa son capaces de detectar niveles bajos de infección en animales portadores, pero aún pueden diagnosticar equivocadamente falsos negativos (1). El PCR también se puede usar en la detección de Anaplasma marginale en garrapatas. Esto permite determinar la prevalencia de garrapatas infectadas en áreas endémicas, lo cual es de ayuda en las estrategias de control de la garrapata (6).
Debido a los signos clínicos que se presentan como fiebre, anemia hemolítica e ictericia, el diagnóstico diferencial incluye babesiosis, teileriosis, leptospirosis, hemoglubinuria bacilar, toxicidad por plantas y ántrax. Sin embargo, la ausencia de hemoglobinuria en los casos agudos, así como la identificación de los eritrocitos parasitados permiten diferenciar la anaplasmosis clínica de las otras enfermedades (6).
Tratamiento
El tratamiento para la anaplasmosis bovina generalmente consiste en el uso de imidocarb y tetraciclinas (oxitetraciclina y clortetraciclina). Sin embargo, este tratamiento es indicado para el control de la infección activa, ya que no logra eliminar de manera eficiente las infecciones persistentes y no hay evidencia de que prevenga la infección con A. marginale en el ganado (1).
Cuando la enfermedad clínica es severa, es necesaria una terapia de soporte adicional al uso de antibióticos, por lo que es necesario el uso de hidratantes, antihistamínicos y analgésicos (6). La clortetraciclina vía oral se ha usado como terapia para el tratamiento de anaplasmosis bovina en el ganado de carne, demostrando ser efectiva en la enfermedad clínica al reducir los niveles de parasitemia y los signos clínicos. Sin embargo, este tratamiento tampoco ha sido efectivo para eliminar las infecciones persistentes (1).
Un estudio in vitro encontró que la enrofloxacina inhibía A. marginale en un cultivo de eritrocitos. Luego se desarrollaron experimentos in vivo donde se evaluó su eficacia contra infecciones graves en terneros esplenectomizados y en infecciones persistentes. Sin embargo, los resultados de estos estudios demostraron que la enrofloxacina tenía poca eficacia para el tratamiento de anaplasmosis bovina (1).
Control y prevención
Las medidas de control y prevención para la anaplasmosis bovina consisten principalmente en el mantenimiento de rebaños libres de Anaplasma a través del control del movimiento e importación del ganado, pruebas diagnósticas y eliminación del ganado portador; control de vectores, prevención de la transmisión por fomites y la utilización de vacunas (1).
Inmunidad
Una vez el ganado se recupera de la infección aguda desarrolla resistencia a la enfermedad clínica con la misma cepa. Sin embargo, mantienen una infección persistente que se caracteriza por los bajos niveles de A. maginale. A estos animales también se les conoce como portadores y sirven como reservorios al proporcionar sangre infecciosa para la transmisión mecánica o biológica (3).
Mantenimiento de rebaños libres de Anaplasma
El mantenimiento de rebaños libres de anaplasmosis es más fácil de lograr en áreas donde la prevalencia de la infección es baja ya que se necesitan realizar pruebas diagnósticas a todos los animales del rebaño, así como a cualquier animal nuevo que ingrese en este. Cualquier animal positivo que se detecte debe ser eliminado del rebaño debido a que son una potencial fuente de infección para otros animales. Debido a que las pruebas de diagnóstico pueden arrojar falsos negativos, se pueden muestrear a los animales dos veces en un intervalo de 3 semanas para poder reducir este riesgo (1).
Control de vectores
El control de garrapatas y moscas mordedoras en el medio ambiente es un trabajo arduo y costoso, además de ser un problema constante de contaminación ambiental (1). Sin embargo, la protección antiparasitaria sobre el animal representa una mejor opción para reducir la incidencia de infecciones con Anaplasma marginale. Se pueden usar distintos tipos de ectoparasiticidas en bovinos como cipermetrina, fipronil, ivermectina o abamectina (7).
Las asociaciones de ectoparasiticidas como fipronil y compuestos inhibidores del desarrollo como el fluazuron han demostrado ser bastante efectivas en el control de garrapatas. Las aplicaciones dorsales (pour on), tienen la ventaja de ser fáciles y rápidos en su aplicación (3). No obstante, el tratamiento debe seguirse rigurosamente bajo las indicaciones del médico veterinario debido a que un tratamiento inadecuado frecuentemente lleva a la resistencia de las garrapatas al antiparasitario (7).
Prevención de la transmisión por fomites
La transmisión a través de fómites contaminados con sangre puede contribuir a la propagación de la anaplasmosis bovina en el rebaño. Para evitar este tipo de transmisión se deben tomar acciones como utilizar una aguja por animal, desinfectar los instrumentos quirúrgicos debidamente antes de realizar las castraciones o descornes, desinfectar aparatos como equipos de tatuaje, etiquetadores de orejas y pinzas para la nariz (1).
Vacunación
La vacunación es una forma económica y eficaz de controlar la anaplasmosis bovina en distintos países alrededor del mundo. Las vacunas pueden dividirse en vacunas vivas y vacunas muertas y ambos tipos inducen una inmunidad protectora que reduce o previene la enfermedad clínica. Sin embargo, no evitan que los animales puedan adquirir la infección persistente (3).
Las vacunas vivas implican la infección del ganado mediante la inoculación de eritrocitos infectados con aislamientos menos patogénicos de Anaplasma. El ganado vacunado desarrolla infección persistente que induce inmunidad protectora de por vida y normalmente no requiere revacunación. Sin embargo, existe el riesgo de desarrollar enfermedad aguda en algunos individuos (3).
Las vacunas muertas tienen la ventaja de que las reacciones posteriores a la inoculación tienen una importancia clínica mínima a diferencia de las vacunas vivas. Sin embargo, una desventaja frente a estas es que la inmunidad protectora que otorgan suele ser menor, por lo que requieren una revacunación periódica (3).
Conclusiones
La anaplasmosis bovina es una enfermedad que dependiendo de la edad en la que se infecte el ganado puede tener una alta mortalidad lo cual afecta gravemente la producción. Además, es difícil de erradicar debido a que los animales recuperados continúan como portadores por el resto de su vida.
El tratamiento permite la recuperación de la enfermedad clínica pero generalmente no elimina por completo al A. marginale. Por lo que las medidas de prevención cobran mayor importancia para evitar la infección en el ganado.
Referencias
- Aubry P, Geale DW. A review of bovine anaplasmosis. Transbound Emerg Dis. 2011; 58(1):1-30.
- Parodi P, Armúa-Fernández MT, Schanzembach M, Mir D, Benítez-Galeano MJ, Rodríguez-Osorio N, Rivero R, Venzal JM. Characterization of strains of Anaplasma marginale from clinical cases in bovine using major surface protein 1a in Uruguay. Front Vet Sci. 2022 Sep 20;9:990228.
- Kocan KM, de la Fuente J, Guglielmone AA, Meléndez RD. Antigens and alternatives for control of Anaplasma marginale infection in cattle. Clin Microbiol Rev. 2003; 16(4):698-712.
- Glen A. Scoles, J. Allen Miller, Lane D. Foil, Comparison of the Efficiency of Biological Transmission of Anaplasma marginale (Rickettsiales: Anaplasmataceae) by Dermacentor andersoni Stiles (Acari: Ixodidae) with Mechanical Transmission by the Horse Fly, Tabanus fuscicostatus Hine (Diptera: Muscidae) , Journal of Medical Entomology, Volume 45, Issue 1, 1 January 2008, Pages 109–114.
- Casas E, Trigueros A, Chavez A, Tang J, Ruiz F. Tratamiento y control de garrapata Boophilus microplus, a través de la combinación de Fluzuron/ Fipronil pour on, en bovinos de trópico, Pucallpa, Perú. UNMSM: Laboratorio de Parasitología-IVITA Pucallpa. 2009.
- Corona B, Rodriguez M, Martínez S. Anaplasmosis bovina (bovine anaplasmosis). Redvet. 2005; VI(4): 1-27.
- Rajput ZI, Hu SH, Chen WJ, Arijo AG, Xiao CW. Importance of ticks and their chemical and immunological control in livestock. J Zhejiang Univ Sci B. 2006; 7(11):912-21.






Necesito nombre de medicamentos para tratamiento de la anemia producidas por garrapatas
Hola Jovita, gracias por escribir. Para el tratamiento de anemias de origen parasitario tenemos Hematofos B12®. Además, es estimulante del apetito, crecimiento y producción.